2018年已有53个新药获FDA批准 这5款最具商业潜力
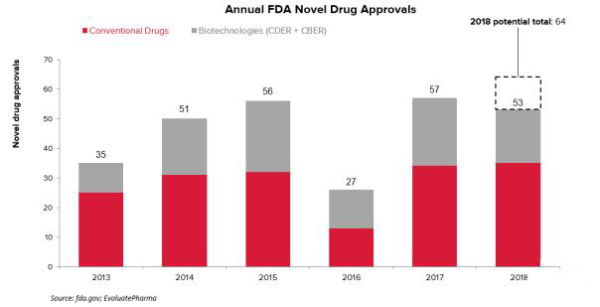
根据医药市场调研机构EvaluatePharma旗下EP Vantage近日发布的数据,在2017年,美国FDA共批准了57个新药,是过去5年中批准新药数量最多的一年。而2018年迄今为止,FDA已经批准了53个新药,在距离年底仅剩的6周内,还有多达11个药物将面临FDA的审查决定。这也意味着,在2018年,FDA批准的新药数量注定将再创新高。
2018,FDA的“杀伐决断”
EP Vantage指出,在2018年,FDA对一些高调和高风险项目做出了积极的裁决,其中对药物开发商而言至关重要的一些项目包括:GW制药公司的全球首个植物来源大麻素新型抗癫痫药物Epidiolex(cannabidiol,大麻二醇)、Alnylam公司的全球首个RNAi药物Onpattro(patisiran),以及Array公司的黑色素瘤药物MEK抑制剂Mektovi(encorafenib)。
不过,也有一些新药项目并没有这么幸运,例如Ionis公司的反义RNA药物Waylivra(volanesorsen),该药在前期虽已获得了FDA专家委员会支持用于治疗超罕见病家族性乳糜微粒血症综合征(FCS),最终却遭到了FDA的否决。不过总体来看,在过去几年中行业规模较小的公司能够赢得FDA批准,确实能助推其生物技术的估值。如果说从当前的新药批准数量中能够传递出什么信息的话,那就是对良性监管环境的信心应该持续下去。
2018年最具商业潜力新药
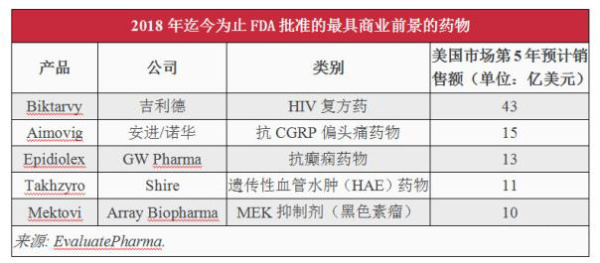
根据EP Vantage的分析,在2018年中,FDA批准的最具商业潜力的新药是来自吉利德的三合一HIV复方药Biktarvy,该药的预期成功在很大程度上将依赖于吉利德现有的特许经营权。而在2019年,抗CGRP偏头痛药物类别将会受到行业更密切的关注;在2018年中,FDA已批准了来自安进/诺华、礼来、梯瓦的3款抗CGRP偏头痛药物,这3款药物在美国市场上市后第5年的合并销售额预计为28亿美元,但这些预防性疗法是否能够达到预期,在业内也存在着一些争议。
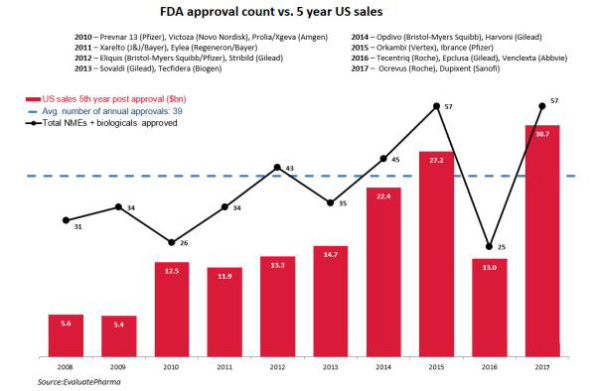
尽管2018年批准的新药数量尚未最终确定,但对于已进入市场的那些药物,根据行业分析师的乐观估计,在美国市场的第5年合计销售潜力预计为210亿美元。考虑到目前还有多个新药等待批准,而且从历史数据来看,这一数字实际上是一个很低的数字。
剩下6周还有哪些值得期待?
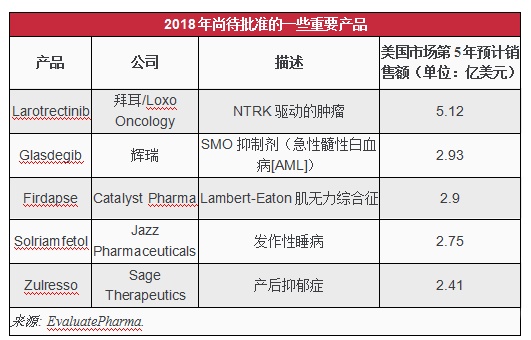
根据处方药用户收费法(PDUFA)目标日期,在2018年剩下的6周内,还有一些药物正在等待FDA的审查结果,其中最引人注目的是下表这些药物,包括拜耳和LoxoOncology公司的“广谱”靶向抗癌药larotrectinib以及Catalyst制药公司的罕见病药物Firdapse。同样,FDA的审查决定对于涉及这些药物的小型制药公司而言也至关重要。
即便到目前这一阶段,也还是很难对2018年FDA批准的新分子实体(NME)最终数量做出准确预测,这是由于其中一些新药项目可能无法通过审批,另一方面FDA也可能提前批准PDUFA日期为2019年的一些新药项目。值得注意的是,Vantage统计的NME包括了FDA下属2个机构药品审评与研究中心(CDER)和生物制品审批与研究中心(CBER)批准的新分子。
实际上,审批的确切数量是无关紧要的,重要的是长期的趋势,这可以清晰地反映出监管机构的态度。许多行业分析师认为,在过去几年中,FDA一直在努力推动生物技术领域的进步,这一点在2019年应该不会有太大的变化。
参考资料:
Novel drug approvals set to hit a new record in 2018
来源:新浪医药
版权及免责声明:本网站所有文章除标明原创外,均来自网络。登载本文的目的为传播行业信息,内容仅供参考,如有侵权请联系答魔删除。文章版权归原作者及原出处所有。本网拥有对此声明的最终解释权。


{replyUser1} 回复 {replyUser2}:{content}