生物大分子药物新型给药系统离患者还有多远?
一、生物大分子药物及给药系统概述
大分子药物也被称为生物制品,主要包括多肽、蛋白质、抗体、聚糖与核酸药物等。近年来,全球生物制药市场发展迅速,呈现出高速增长的态势,根据 F&S 报告,全球生物药市场预计将自2017 年的 2,402 亿美元,增至 2022 年的 4,040 亿美元,复合年增长率为11.0%。其中体药物尤其是新型抗体药物,俨然已是生物制药领域最热门的细分市场。随着新技术、新型抗体的不断发展,临床应用也已从肿瘤和免疫疾病拓展至心血管、胃肠道、呼吸和感染等领域,病人群体也呈现多样化趋势。在2017年全球TOP10畅销药物中,生物制剂占据了八席之多。
表2017年全球TOP10畅销药物
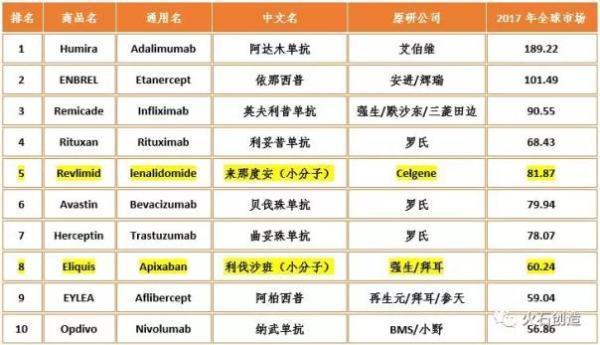
数据来源:各公司年报、IMS,火石创造整理
然而,大分子生物药物由于经胃酸、酶和肝肠循环容易被代谢分解特点,临床上获批的生物制剂大部分采取注射给药的方式。但注射给药所带给患者的恐惧、安全性问题、注射部位疼痛以及需要至门诊或住院接受治疗等,给药不方便以及治疗成本的提高所带来的依从性问题,导致很大一部分患者主动或被动逃避使用。为了减轻患者的负担,多年来世界各国药物学家一直致力于新剂型和新给药途径的研究,涉及的新型给药策略包括肺部吸入给药制剂、植入剂、口服或口腔黏膜给药制剂、透皮制剂等。但在筛选给药途径时,大分子的渗透性差,大部分生物药物分子较大、易聚集和降解等特点,以及难以穿透人体天然屏障,如皮肤、胃肠上皮等,且口服给药途径会导致生物药物在胃肠道中被降解等问题一直是大分子在非侵入性给药途径无法逾越的障碍。目前,临床中研究的最多的为肺部吸入、口服和透皮给药。
图1.非侵入性给药途径的优缺点
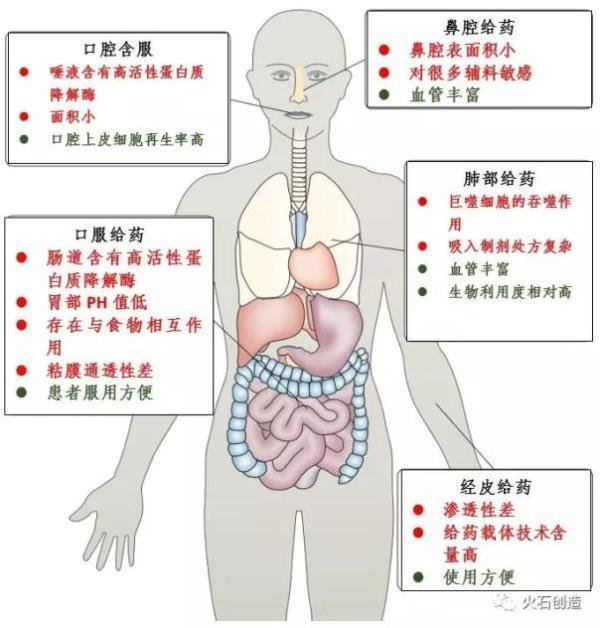
(红色为缺点,绿色为优点)
图片来源:NatureChemistry
二、吸入给药在大分子药物的研究及应用
吸入制剂系指通过特定的装臵将药物以雾状形式传输至呼吸道和/或肺部以发挥局部或全身作用的制剂。肺部具有吸收表面积大、毛细血管网丰富的特殊生理结构,以及无消化酶和胃酸破坏、无肝首过效应等特点决定了其给药途径的优势。目前,生物制剂采用吸入给药途径治疗全身系统性疾病的主要有两款胰岛素制剂。首个吸入胰岛素是由辉瑞公司开发的商品名为Exubera,于2006年1月26日获美国FDA批准,但由于产品本身设计不被患者接受以及临床上存在诸多的安全性担忧,上市后销售业绩糟糕,于是在2008年无奈退出市场。继Exubera撤市之后,2008年诺和诺德、礼来也先后宣布终止了其产品管线中吸入型胰岛素的开发进程。
Afrezza是由Mannkind公司开发的,继辉瑞Exubera之后全球第2只上市的吸入胰岛素产品。Mannkind公司没有因辉瑞Exubera产品的失败而放弃吸入型胰岛素的开发,在Afrezza项目继续投入数10亿美元。在经历了两次遭FDA拒绝之后,在充分分析了Exubera失败的原因并基于其问题进行了改进,Afrezza终于于2014年6月得以破土而出,获得FDA批准上市。并且Mannkind公司还与赛诺菲达成了销售合作协议,Mannkind公司负责Afrezza的生产,而赛诺菲负责Afrezze在全球的注册、销售和商业推广。赛诺菲为此还向MannKind支付1.5亿美元预付款,并承诺未来支付总额不超过7.75亿美元的里程碑以及35%的销售收入分成。
然而,Afrezze产品似乎并未改写吸入型胰岛素的命运,上市后销售表现不佳。2016年赛诺菲也终止了与Mannkind公司的合作。目前,吸入制剂还处于活跃在研状态的已聊聊无几,而生物制剂开发吸入给药剂型的共有235项在研,但其中31%仍处于发现阶段,32%显示为无进展或已终止。从治疗的适应症分布来看,目前主要用于肺部疾病及其抗感染药物局部靶向性的治疗,而用于全身系统性治疗的吸入制剂开发不仅在大分子还是小分子药物的开发似乎均困难重重。
图3.大分子生物制剂的吸入给药临床阶段及适应症

目前,长期安全和疗效、肺毒性及肺功能的影响、以及吸入装置带来的治疗成本提高等问题会是吸入制剂在全身给药开发最大的障碍。另外政府药物监管部门对吸入制剂更严格的审批程序、暗淡的市场前景等。这些内部和外部阻力导致研发前景并不乐观。
三、透皮给药技术在大分子生物药的研究
透皮给药系统(TDDS)是指在皮肤表面给药,使药物以恒定速率(或接近恒定速率)通过皮肤,进入体循环产生全身或局部治疗作用的新方法。透皮递送虽然具有挑战性,但相对于口服、静脉或肠道等方式,透皮给药具有灵活给药、使用方便,提高患者的顺应性等显著优势。因此,经皮给药系统的研究一直是业内高度关注的技术。
然而,皮肤角质层的屏障作用使得药物透皮速率和渗透量难以满足治疗的需求,是开发透皮给药制剂的重大障碍,尤其是大分子生物药类。目前,透皮给药系统在小分子治疗药物中的研究和应用已取得显著的成功,例如尼古丁、止痛药以及卡巴拉丁和罗替高汀等用于神经系统疾病治疗的药物。近年来,随着新材料、新工艺和新设备的不断发展,透皮给药技术已从第一代简单的依赖于化学物质自然扩散的方法发展到第四代通过可穿戴设备外部刺激的药物释放系统,包括化学促渗剂、电穿孔技术、微针技术、离子导入技术、超声促渗技术、激光促渗技术和热穿孔技术等。经皮给药系统理论和促渗透方法的研究取得的进展,使更多药物开发成TTS制剂成为可能。
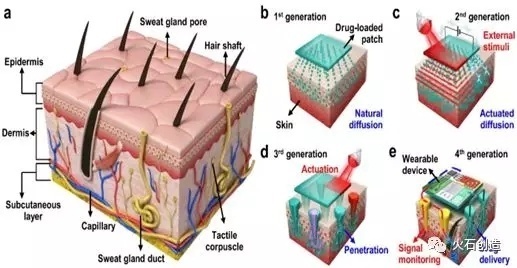
备注:(a)人体皮肤的示意图。(b)通过药物的自然扩散的第一代透皮药物递送技术,主要为。(c)第二代透皮药物递送技术,通过外部驱动力使用化学增强剂和刺激剂来改善药物的皮肤渗透性。(d)第三代透皮药物递送技术,通过微针介导的皮肤层破坏以及微针的各种功能来增强药物转运。(e)第四代透皮给药技术,在可穿戴设备的帮助下进行患者的个性化治疗。
例如微针(microneedle)的出现给生物大分子经皮给药带来了曙光。微针的类型可分为实心微针和空心微针两大类。其中,空心微针阵列具有注射器与经皮给药贴剂的双重点,适用于液态和治疗剂量要求更大的药物,特别适合核酸类、多肽类、蛋白疫苗等生物技术药物的给药。
图5.透皮给药系统中的微针示意图
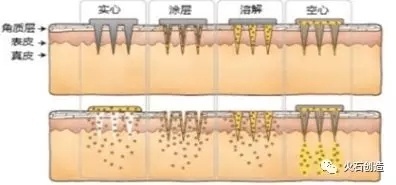
图片来源:NatureChemistry
例如,Transdermal Specialties公司开发的U-Strip超声波透皮给药系统,通过胰岛素贴片(Insulin Patch™)应用特殊的超声波传输,扩张和扩大皮肤毛孔,使大分子药物穿透汗毛孔,然后进入血液。Prometheon Pharma公司的推出了NoPricks无针胰岛素贴片,一种无针多日基础胰岛素贴剂,可为日常针头注射提供简单,方便且经济实惠的替代品。
但可穿戴传感器以及结合先进的透皮贴剂、微针等新型技术在生物大分子给药系统的开发仍处于早期阶段,在理论及技术均取得了一定的进展。但如何提高药物通过皮肤,以及它们在各种疾病模型中的应用,使现在不可能透皮吸收的大分子药物可以实现透皮给药,未来的研究仍存在一个很大的空间。
四、口服给药在大分子生物药的研究
口服给药途径方便,患者依从性好,是最受欢迎也是最理想的给药方式之一。但大分子多肽、疫苗以及单抗类药物,口服后易被消化道酶水解、破坏,容易聚合,难以被胃肠道吸收,肝脏的首过效应等使得口服生物利用度非常低,个体差异较大且可能存在安全隐患。如何利用新技术保护生物制剂在胃肠道中不被破坏,提高生物大分子的亲脂性和渗透性,并且又能恰到其时地释放药物一直是这个领域公认的难题。
口服给药是目前生物大分子药物在开发非侵入给药途径研究最多的新型给药策略。据统计,目前处于活跃状态的口服给药约有300多个,但其中有200多个仍处于发现阶段,另有300多个项目显示为无进展或已终止,也从侧面反映了生物大分子给药开发的挑战性。
图8.生物大分子药物口服给药研发阶段分布
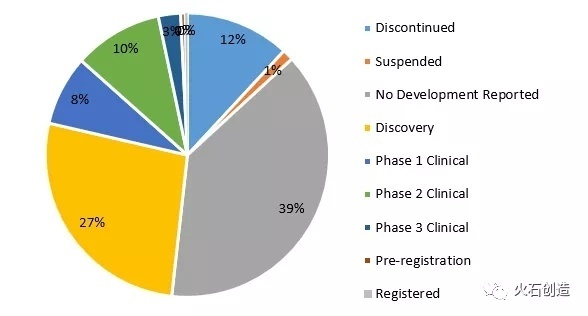
口服胰岛素的开发是目前在生物大分子口服给药开发历史最早的一类药物。早在1922年,现代糖尿病学创始人Joslin博士就开始尝试研发口服胰岛素。之后,包括诺和诺德在内,约有几十家公司尝试口服胰岛素的开发,但多数以失败或看不到希望而终止。Diasome公司的OralHDV-insulin应该是首个FDA批准的进入III期临床研究的口服胰岛素,但之后无相关进展报道。Oramed 公司的ORMD0801项目可能是炒的最热的一款口服胰岛素,公司早在2013年12月宣布其口服胰岛素肠溶胶囊制剂ORMD 0801的II期临床试验成功,期间还和两家企业签订过合作协议,但截至目前公司的Pipeline仍显示为II期状态。目前,临床上还有多个口服胰岛素在研处于活跃状态,但是否取得胰岛素给药方式革新式的成功,仍待临床进一步验证。
为提高生物大分子的生物利用度,目前的开发策略之一是使用渗透增强剂、酶抑制剂等功能性辅料的作用。通过与亲脂性物质的共价或非共价键合来修饰生物API结构,以及包封和/或使用保护性(肠溶胶囊技术)包衣防止化学和酶促降解。例如,Emisohere的Eligen技术,它使用N-[(2-羟基苯甲酰)胺基)]辛酸钠(SNAC)与生物药物非共价结合,通过加强肠上皮细胞膜的流动性和药物及载体的跨膜运输,增加药物在胃肠道的吸收。诺和诺德的GLP-1类似物索玛鲁肽口服制剂即采用的是Eligen®技术,目前已有多个三期临床在研,其中4个临床数据已经披露,也是在降糖和降体重上获得全胜。索玛鲁肽已经横扫其他降糖药,但主要缺点是贵;口服版预计于2019年美国上市,给药剂量是注射剂用量的100倍,且每日一次给药,治疗成本可能会更高。
目前,在生物大分子口服给药技术开发成为头条新闻的创新产品是由Rani Therapeutics公司开发的一款机器人药丸。Rani的机器人药丸是一种复杂的装置,其中固体药物被放置在微小的、可溶解的针内,组装成球状结构并折叠在胶囊中。胶囊为pH敏感的肠溶包衣,使其能够通过胃而不会降解。当胶囊到达人体内肠道中时,随着pH值和酸度变化,聚合物制成的胶囊外壳被溶解。药片中原本被分隔开的柠檬酸和碳酸氢钠混合在一起,两种物质混合产生的二氧化碳成为了药片的“动力”,使得内部的微型气球状结构逐渐膨胀,把由糖制成的针推到肠壁上,预装的药物将通过这个针慢慢注射到人体中。随后,附在肠壁上的糖针将被溶解,而气球结构和聚合物外壳将被逐渐溶解最后排出体外,不会堵塞在体内。肠壁的高血管分布有助于快速吸收,并且由于肠道中没有疼痛感受器,因此注射后不产生痛感。但目前该项目还处于临床前阶段,尚未在人体上进行测试。
图8. Rani的机器人药丸的体内给药过程
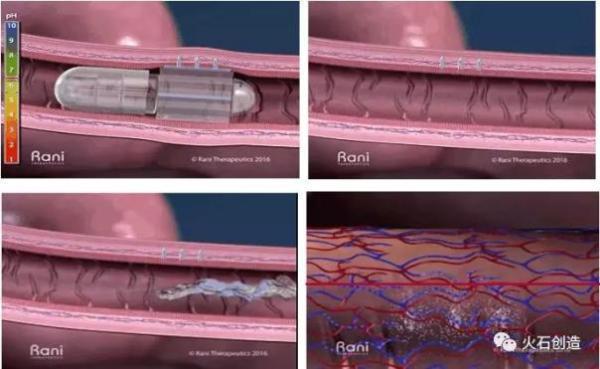
图片来源:Rani Therapeutics公司
(从左至右,由上到下:1-2-3-4)
据该公司称,机器人药丸中使用的成分是经FDA批准的可注射和可吸收的材料,可安全吸收并排出体外。根据Rani Therapeutics所说的这项技术可以应用于任何分子量的生物制剂,无论其结构或性质如何,因此,吸引了包括诺华和阿斯利康等在内的许多制药企业的兴趣。
另外,抗体药类药物作为生物药中的王牌,也是各制药企业的必争之地,目前也已着手新型给药技术的开发。但抗体药物的口服给药开发仍处于较早期阶段,且从适应症的开发选择上,主要考虑靶向性肠道疾病的局部治疗如克罗恩病和肠易激综合征,可能相对于其他适应症的开发更容易实现口服给药。
表2.抗体药物口服给药制剂在研药物(部分)

数据来源:cortellis
五、结 语
随着全球医药公司及制药企业对生物大分子药物关注的日益增加,在研发资源和资金的不断投入、技术的不断进步以及对疾病认识的不断提高,促使研发公司及制药企业不断研发出具有卓越疗效和安全性的创新生物药。虽然,生物大分子新型给药制剂开发的挑战仍在继续,但新型给药策略可以改进治疗方案,提高患者的依从性和便利性等。同时也可为创新型公司提供产品的差异化竞争以及重磅生物药原研公司保护其现有地位,未来几年仍将是医药研发技术的热门以及资本高度关注的一个领域。
参考文献:
[1]Zelikin, A. N., Ehrhardt, C., & Healy, A. M. (2016). Materials and methods for delivery of biological drugs. Nature Chemistry, 8(11), 997-1007.
[2]https://www.drugdevelopment-technology.com/projects/exubera/.
[3]https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2769732/.
[4]https://www.afrezza.com/.
[5]http://www.mannkindcorp.com/.
[6]HyunjaeLeea,ChangyeongSong,et. Device-assisted transdermal drug delivery. Advanced Drug Delivery Reviews. Volume 127, 1 March 2018, Pages 35-45.
[7]https://www.zosanopharma.com/pipeline/.
[8]http://www.transdermalspecialties.com/products.html.
[9]http://www.prometheonpharma.com/technology/.
[10]Jin Woo ParkSang Kyoon Kim,et. Strategies for oral delivery of macromolecule drugs. Biotechnology and Bioprocess Engineering,February 2010, Volume 15, Issue 1, pp 66–75.
[11] E.Moroz,etal.,Oral delivery of macromolecular drugs: Where we are after almost 100 years of attempts,Adv.DrugDeliv. Rev. (2016).
[12]https://www.novonordisk.com/content/Denmark/HQ/www-novonordisk-com/en_gb/home/media/news-details.2200408.html
[13]Vllasaliu, D., Thanou, M., Stolnik, S., & Fowler, R. (2018). Recent advances in oral delivery of biologics: nanomedicine and physical modes of delivery. Expert Opinion on Drug Delivery, 15(8), 759–770.
[14]R. Savla, O. Hartwig, W. W. L. Chin, B. Loretz, and C.M. Lehr, “Oral Delivery of Macromolecular Drugs" Pharmaceutical Technology 42 (7) 2018.
[15]A. Siew.Emerging Technologies Advance Oral Drug Delivery.Pharmaceutical Technology 42(6)18-20(2018).
来源:新浪医药
版权及免责声明:本网站所有文章除标明原创外,均来自网络。登载本文的目的为传播行业信息,内容仅供参考,如有侵权请联系答魔删除。文章版权归原作者及原出处所有。本网拥有对此声明的最终解释权。


{replyUser1} 回复 {replyUser2}:{content}