Nature子刊:优瑞科公布AbTCR-T细胞疗法临床前数据
CAR-T细胞疗法在过去一年获得了足够关注,FDA连续批准了两款CAR-T产品:诺华的Kymriah和吉利德/Kite Pharma的Yescarta。截止目前为止,国内已有五家公司的六款CAR-T产品获批临床。
虽然CAR-T细胞疗法在CD19阳性血癌如淋巴瘤和白血病中显示出显著的功效,但是细胞因子释放综合征(CRS)和神经毒性(neurotoxicity, NT)等危及生命的副作用限制了CAR-T疗法的临床应用。
近日,优瑞科生物技术公司(Eureka Therapeutics)公布其专有的ARTEMIS抗体-TCR(AbTCR)受体平台的临床前研究数据,证明AbTCR-T细胞与现有的抗CD19 CAR-T细胞具有一致的抗癌效力,但炎性细胞因子的产生显著降低,减少CRS和NT的风险。

该研究于11月20日发表在Nature子刊Cell Discovery上,通讯作者是优瑞科的创始人兼首席执行官刘诚博士,费城儿童医院的Stephan A. Grupp博士和David Barrett博士也参与了这项研究。
刘诚博士(图片来源:Eureka Therapeutics)
对比传统TCR-T:突破MHC限制
T细胞由其细胞表面上存在的TCR分子定义。TCR 识别异常细胞抗原,并触发T细胞活化和随后的肿瘤细胞裂解的级联信号事件。在大多数T细胞中,TCR由α链和β链组成,而在1-5%的T细胞中,TCR由γ链和δ链组成。
αβ链(或γδ链)的细胞外区域负责抗原识别和结合。抗原结合通过多聚体CD3复合物刺激下游信号传导,该复合物与αβ(或γδ)链的细胞内结构域结合为三聚体(εγ、εδ、ζζ)
不输于CAR-T,TCR-T细胞疗法是目前一个活跃的研究领域,并且已经在临床试验中获得不错的疗效。该疗法通过分离肿瘤特异性TCRα和β链并将其克隆到转导载体中,转导T细胞以产生肿瘤抗原特异性T细胞。
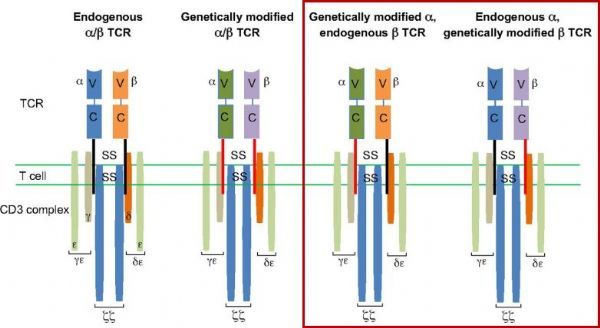
然而,目前大部分TCR-T疗法的靶标受MHC(主要组织相容性复合物)限制。此外,外源性与内源性αβ链之间存在杂交(错配)风险,可能诱导自体抗原的有害识别,导致移植物抗宿主病。
左起:内源TCR、工程化TCR、两种可能杂交(错配)TCR的结构(图片来源:biologists)

AbTCR的结构(图片来源:Cell Discovery)
优瑞科的AbTCR设计将抗体的Fab结构域与来自γδ TCR的效应结构域融合,将抗体识别的亲和力和特异性与T细胞的肿瘤细胞毒性潜力相结合。既可以利用内源性TCR信号传导途径,同时通过使用TCR-mimick(TCRm)抗体靶向肽-MHC复合物或使用常规抗体靶向细胞外抗原,具有灵活性。
TCR-mimick抗体
Eureka研发的针对胞内抗原肽/MHC复合体靶点的治疗性抗体,在业界也被称为TCR-mimick抗体、TCRm抗体或TCR样抗体。
虽然大多数以胞内抗原为靶点的方法都涉及到可穿透细胞的化合物,但是TCRm是从细胞外部起作用。其技术原理概括如下:Eureka专有抗体技术开发平台通过靶向MHC/免疫肽段复合物来发现识别肿瘤细胞内的特异性抗原。这些抗体因而能有效识别癌细胞内的特异蛋白质,然后调动免疫系统攻击相关肿瘤细胞。
与TCR-T平台类似,AbTCR能够与CD3复合物结合,使得抗原/AbTCR参与触发内源性T细胞活化和调节途径。然而,与大多数TCR-T平台不同的是,基于γδ TCR的细胞内结构域和用于靶识别的抗体结合部分,AbTCR平台能够扩展到非MHC限制的目标(例如CD19),并且避免了与T细胞内源性αβTCR的错配风险。
此外,γδ TCR亚基对CD3具有比αβTCR更高的亲和力,有利于增强下游转导信号。
有望降低CRS、NT风险
CAR-T和TCR-T这两种技术的一个共同点在于通过基因改造的手段提高T细胞受体对特异性癌症细胞抗原的识别能力和进攻能力。
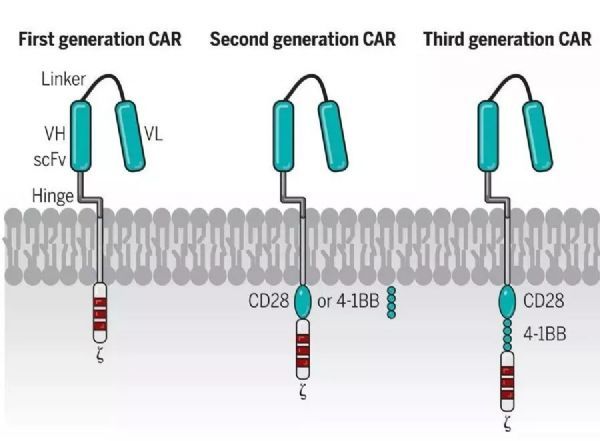
通常地,CAR由来自mAb的单链可变片段(scFv)、细胞外间隔区(称为铰链)、跨膜结构域、CD3ζ信号传导结构域和通常一或两个(第二代或第三代)共刺激结构域组成。CAR赋予T细胞以不依赖于MHC的方式通过scFv(抗体识别)直接结合表面抗原的益处,并通过CD3ζ和共刺激结构域同时向T细胞传递信号。
CAR的结构(图片来源:Science)
然而,抗原识别与细胞激活结构域的直接融合产生合成激活信号,其可能不同于内源性TCR-CD3复合物介导的细胞激活信号。
CRS是与靶抗原结合后CAR-T细胞不受控制的过度刺激的结果。在CAR-T细胞中,信号传导结构域(CD3ζ)和共刺激结构域(CD28或4-1BB)融合到CAR受体构建体中。与靶抗原(例如CD19)结合后,CAR-T细胞激活并在杀死癌细胞的过程中分泌细胞因子。然而,细胞因子不受控制的产生可导致CRS和NT等副作用。
AbTCR不利用CD3ζ与CD28/4-1BB融合,相反,它包含Fab片段的基于抗体的抗原结合结构域,所述Fab片段被工程化到γδ TCR链的效应结构域上。理论上,这允许AbTCR形成与内源性CD3链的多聚T细胞信号传导复合物,利用自然激活和TCR受体的调节途径,以控制细胞因子的产生。
细胞水平上的表征:AbTCR-T具有治疗潜力
为了进行功能上的表征,优瑞科的研究人员开发了人抗CD19抗体(ET190L1),并比较了ET190L1-AbTCR-T细胞和ET190L1-CAR-T细胞(使用CD28和CD3ζ)在抗原刺激前后的表型。
>>>>抗原刺激前
在制造期间,ET190L1-AbTCR-T细胞以与ET190L1-CAR-T细胞相似的生长动力学扩增,并产生具有相似转导效率和CD4:CD8比率的T细胞群。
已发表的CAR-T临床研究的回顾性分析发现,初始(naïve)程度更高、分化和衰竭程度更低的T细胞与疗效提高有关。
有趣的是,在CD3/CD28扩增后、抗原结合之前,与ET190L1-CAR-T细胞相比,更大比例的ET190L1-AbTCR-T细胞显示出初始(TN)和干细胞记忆(TSCM)T细胞表型。CD8 + AbTCR-T细胞上的CD28表达增加、颗粒酶B(GranB)减少、CCR7增加,表明用AbTCR工程化的T细胞分化较少。此外,AbTCR-T细胞上表达的衰竭标志物PD-1和TIM-3低于CAR-T细胞。
研究人员惊讶于观察到抗原结合前的差异,因为两种细胞都表达相同的抗原特异性Ab可变序列。他们认为对这种差异最可能的解释是已经报道的基于CD137和CD28的CAR-T细胞的滋养型(tonic)信号。
>>>>抗原刺激后
研究表明,ET190L1-CAR-T细胞和ET190L1-AbTCR-T细胞以抗原依赖性方式触发T细胞活化,仅特异性裂解CD19阳性肿瘤细胞系,同时,两者响应于抗原的增殖动力学、细胞毒性和脱颗粒作用相当。
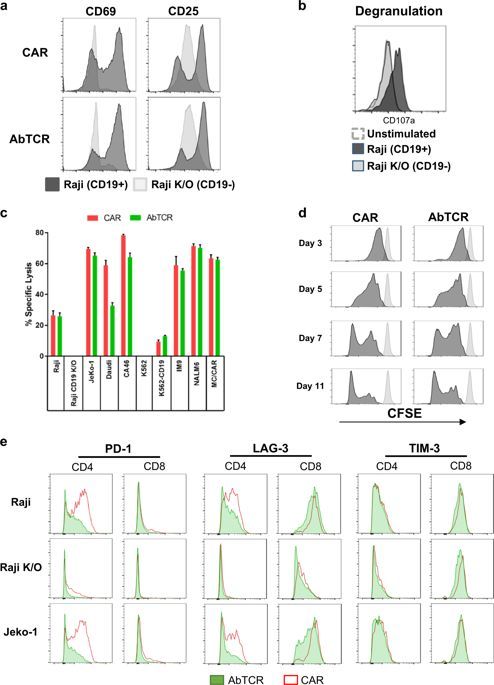
相比ET190L1-CAR-T,ET190L1-AbTCR-T细胞在体外介导抗原特异性应答(图片来源:Cell Discovery)
在肿瘤细胞裂解期间,与CAR-T细胞相比,肿瘤刺激的AbTCR-T细胞上活化标记物CD69和CD25的表达只是略有增加,但与CAR+ CD4+相比,AbTCR+ CD4+细胞表达的衰竭标记物PD-1水平显著降低,并且在CD4+和CD8+ AbTCR-T细胞中,LAG-3也显著降低。
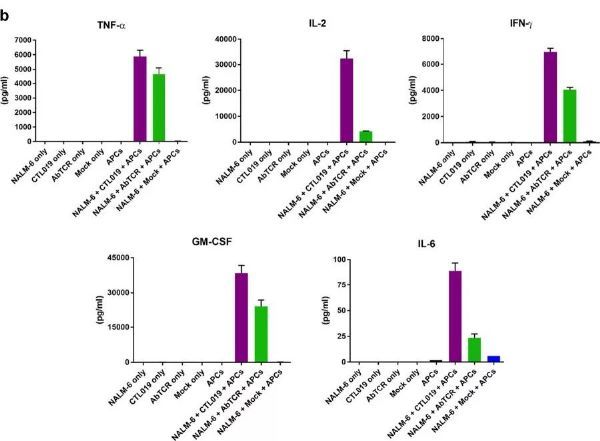
此外,虽然两种细胞具有相当的细胞毒性和增殖潜力,但16小时体外杀伤试验表明,AbTCR-T细胞释放较低水平的炎性细胞因子,包括TNF-α、IL-2、IFN-γ和GM-CSF。
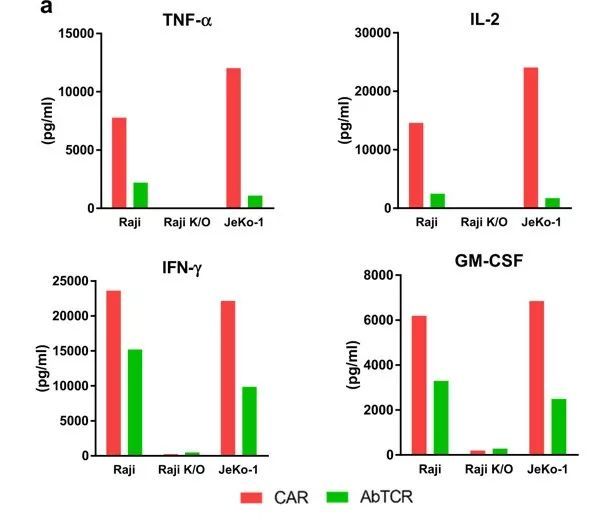
AbTCR-T细胞释放较低水平的炎性细胞因子(图片来源:Cell Discovery)
先前,TCR-T和CAR-T细胞之间的比较已经表明,通过TCR的活化可以相对减少细胞因子释放,同时增加抗原敏感性。
虽然AbTCR没有共价连接的CD28共刺激结构域,但研究中的淋巴瘤细胞(Raji细胞)通过表达CD80和CD86可以为CAR-T细胞和AbTCR-T细胞提供CD28共刺激。因此,研究人员认为AbTCR和CAR之间的细胞因子分泌和衰竭的差异源于AbTCR受体的γδ TCR效应结构域对内源信号传导途径的利用。
临床上已广泛研究的抗CD19 CAR-T细胞CTL019(Kymriah的研究级版本)具有CD137(4-1BB)共刺激结构域,通过比较发现,ET190L1-AbTCR-T细胞相比CTL019同样释放较低水平的TNF-α、IL-2、IFN-γ和GM-CSF。
相比CTL019,ET190L1-AbTCR-T细胞释放较低水平的炎性细胞因子(图片来源:Cell Discovery)
异种移植模型:抗癌效力不减、CRS风险降低
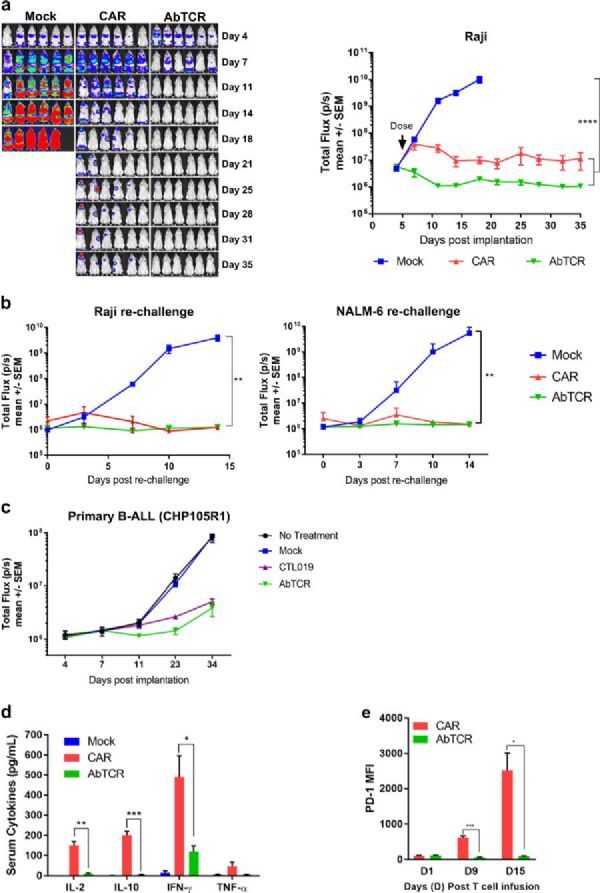
为了测试减少的细胞因子释放是否对体内抗肿瘤活性有影响,研究人员使用原发性B细胞急性淋巴细胞白血病(B-ALL)(CHP105R1,CD80和CD86均为阴性)患者来源的异种移植物(PDX)小鼠模型,并观察到用ET190L1-AbTCR-T和CTL019-T细胞处理的小鼠之间相似的肿瘤抑制。
因此,与上述使用Raji细胞的体外研究一致,AbTCR工程化的T细胞可以减少细胞因子释放而不丧失抗肿瘤活性。
异种移植小鼠模型结果(图片来源:Cell Discovery)
类似地,人CD19+ Raji B细胞淋巴瘤异种移植模型中,ET190L1-AbTCR和ET190L1-CAR治疗均使肿瘤消退和长期肿瘤排斥。
在模拟T细胞处理的小鼠(对照组)必须被安乐死时,ET190L1-CAR-T细胞处理的小鼠的肿瘤负荷比模拟处理的小鼠平均降低~1000倍,而用ET190L1-AbTCR-T细胞处理的小鼠平均降低~5300倍。
在T细胞清除初始肿瘤负荷几周后,研究人员用肿瘤细胞重新注射小鼠来测试存留的ET190L1-AbTCR-T细胞阻止“新引入的”肿瘤细胞生长的能力。研究表明,虽然肿瘤在对照小鼠中快速生长,但先前用AbTCR-T细胞或CAR-T细胞处理的小鼠对Raji淋巴瘤再攻击具有抗性。
体外细胞因子释放和T细胞衰竭标志物的分析结果与体外研究相一致。
ET190L1-CAR治疗引起炎性细胞因子(包括IL-2,IL-10,IFN-γ和TNF-α)的显著升高,而在ET190L1-AbTCR处理组中,这些细胞因子的水平显著低于ET190L1-CAR处理组。给药后9天和15天从外周血收集的T细胞显示,AbTCR-T细胞表达的PD-1水平显著低于CAR-T细胞。
总之,这些数据显示:
AbTCR-T细胞表现出有效的体外和体内抗肿瘤活性,但释放较低水平的炎性细胞因子并表达比CAR-T细胞更低水平的衰竭标志物。
Stephen A. Grupp博士说:“这些数据向更安全的T细胞疗法迈出了关键一步。CRS和相关不良事件仍然是今天使用CAR-T疗法的医生的主要挑战,令人兴奋的是,优瑞科的ARTEMIS技术具有克服这些问题的潜力。”
优瑞科的创始人兼首席执行官刘诚博士说:“传统观念认为,CRS是CAR-T疗法功效的不可避免的副作用。我们已经证明,疗效和CRS有可能脱钩。更安全的T细胞治疗可以为患者带来更大的治疗窗,同时降低患者和整个医疗保健系统的直接和间接成本。”
参考出处:
https://www.nature.com/articles/s41421-018-0066-6
https://www.marketwatch.com/press-release/eureka-therapeutics-announces-publication-of-preclinical-study-validating-its-artemis-platform-designed-to-mitigate-the-risk-of-cytokine-release-syndrome-crs-and-neurotoxicity-2018-11-21
http://dmm.biologists.org/content/8/4/337#sec-4



{replyUser1} 回复 {replyUser2}:{content}