神经疗法:探讨运动如何重塑大脑?

日本札幌北海道大学的Hiroshi Maejima课题组饲养的小鼠每天运动1小时,每周训练5天。研究人员让小鼠们规律运动的目的并非测量它们的肌肉质量或耐力,而是想知道锻炼对哺乳动物大脑有什么影响。
已经有大量动物和人类研究报道,运动有益健康,临床医生开始建议帕金森病和阿尔兹海默症等神经推行性疾病患者以及癫痫、焦虑等其他脑部疾病患者按规律地增加体育锻炼。针对神经退行性疾病、抑郁症甚至衰老的运动干预临床试验正在进行之中。有朝一日,运动将成为一种广泛的神经疗法。
匹兹堡大学的认知心理学家Kirk Erickson说:“没有人相信运动是个神奇的‘万金油’,但这并不意味着我们不应该这么做。”
很早之前,研究人员意识到锻炼可以提高某些认知能力。Maejima和同事们发现,有规律的体育活动可以提高小鼠分辨新事物的能力。在过去20年里,研究人员开始寻找这些益处(海马体积增加、新神经元开始发育以及血管向大脑方向渗透)的根源。如今,Maejima等人找到了驱动体育锻炼给机体带来神经学变化的根本机制。
他们报道,每周进行跑步训练的小鼠大脑海马区组蛋白的乙酰化水平比其他小鼠高,海马被认为是学习和记忆的所在地。这种表观遗传标记导致一种名为大脑驱动神经营养因子(brain-derived neurotrophic factor,BDNF)基因的大量表达。通过支持新神经细胞生长和成熟,BDNF被认为可以促进大脑健康,提高该基因表达水平可以改善小鼠和人类认知相关性能。
探索史
上世纪90年代后期,当时在加州Salk研究所Rusty Gage课题组做博后的Henriette van Praag对一个实验现象特别着迷:笼子里装有玩具和跑轮的小鼠能发育出更多新神经元。这些小鼠的海马比生活在低刺激封闭环境中的小鼠更健康。
van Praa想确定环境中对大脑影响最大的元素是什么。她让一些小鼠学习在水迷宫里游泳,另一些在开阔的水域游泳或跑跑轮或与其他几只小鼠经常互动。12天后,结果出人意料,跑轮组小鼠的新神经元发育最多,是水迷宫和游泳组的两倍!
几个月后,她和同事们发现,跑步所引发的神经发育竟然与记忆水池中隐藏平台位置的能力有关。跑步组小鼠大脑比不跑步组小鼠有更多的突触连接重组,表明运动也影响了神经可塑性。
过去20年研究,科学家陆续发现运动促使肌肉、脂肪和肝组织释放蛋白质等其他物质,从而影响BDFN和其他刺激神经发生、加速新神经成熟、促进脑血管形成甚至增加成人海马体积的物质。
运动的后果
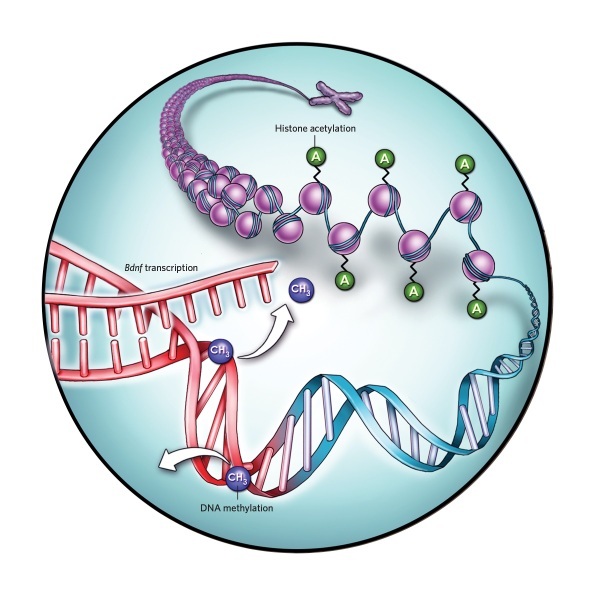
1.脑源性神经营养因子
运动影响神经营养素水平,这种蛋白可以促进神经元增殖并支持其功能。体力活动促进Bdnf基因的DNA去甲基化,增加神经发生促进信号因子表达。此外,组蛋白乙酰化似乎使染色体松动,进一步增强了Bdnf的转录。
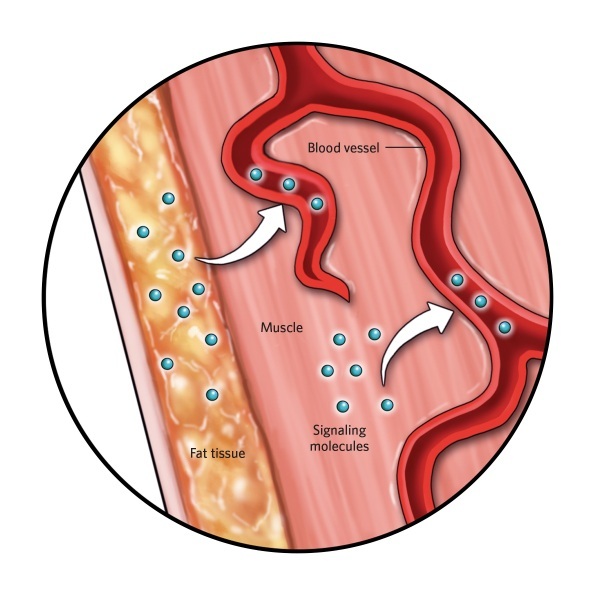
2.血液信号
运动导致肌肉和脂肪细胞分泌影响大脑生长因子水平的信号,通过加速新神经元生长和增加大脑区域体积影响海马形状和功能。
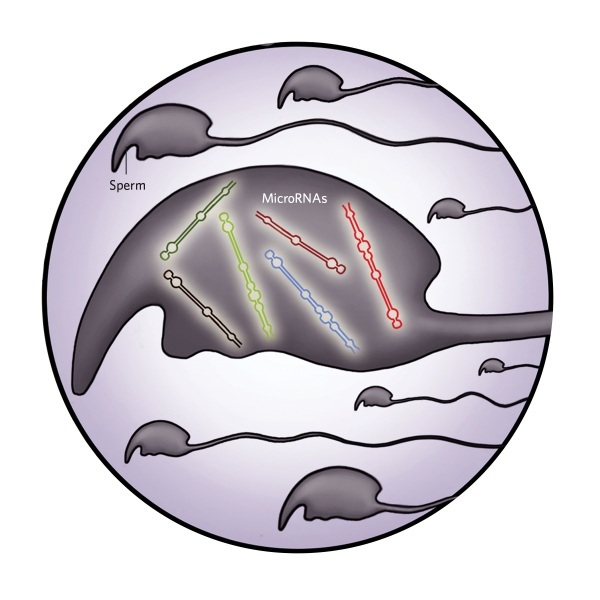
3.精子
健身组雄性小鼠的精子中,与学习和记忆相关的某些microRNAs丰度增加。与久坐组小鼠相比,这些小鼠的后代表现出轻微的认知优势。
这些因素如何改变大脑中的基因表达?
2009年,布利斯托尔大学的神经科学家Hans Reul等人发表了第一项有关运动引起表观遗传变化的研究,他们让小鼠经历有压力的挑战,把它们放进新笼子或强迫它们在烧杯中游泳。那些有规律在跑轮上运动的小鼠比久坐不动的动物在紧张经历后,表现出更少的压力——运动过的小鼠花在探索新笼子或在水中挣扎的时间更少,相反,它很聪明地把头浮在水面上。结果表明,跑步和应激联合诱导的齿状回细胞基因组组蛋白乙酰化水平升高有助于动物更好地应对环境压力。
加州大学洛杉矶分校的神经科学家Fernando Gomez-Pinilla说:“运动引起的表观遗传改变具有调节突触和认知可塑性的显著作用。”
自从Reul课题组报道这项发现以来,至少有20多份有关乙酰化等其他表观遗传变化将运动和啮齿动物大脑联系起来的报道。纽约大学医学院的分子神经学家Moses Chao最近和同事们发现,经常在跑轮上奔跑的小鼠具有更高水平的脑源性神经营养因子和酮类,酮类是肝脏释放的脂肪代谢副产物。将酮注射到未参与跑步的小鼠脑中,有助于抑制组蛋白去乙酰化酶,从而提高海马Bdnf表达。这一发现显示,血液中的分子可穿过血脑屏障,激活或抑制大脑的表观遗传标记。
2016年,van Praag和同事们发现,身体运动期间,肌肉细胞分泌的一种名为组织蛋白酶B(cathepsin B)的物质可以刺激小鼠神经发生。成年海马神经祖细胞培养实验中,组织蛋白酶B可以促进Bdnf表达及其蛋白水平,并增强另外一个名为双皮质素(doublecortin,DCX)的基因表达,DCX基因编码神经迁移所需蛋白,敲除组织蛋白酶B的小鼠在运动后神经发生无变化。
van Praag课题组还发现,在跑步机上运动的人类和非人类灵长类动物运动后血清组织蛋白酶B水平升高,连续4个月,每周跑步45分钟或更长时间,人类参与者根据记忆画出了更准确的图像。
van Praag说,现在一些研究小组已经开始努力寻找运动驱动释放的其他分子,这些分子增强Bdnf和其他促进大脑的基因活性。
现实治疗作用
间经常锻炼所生的孩子比不经常锻炼的母亲的后代优秀(J Pediatrics, 129:856–63)。2016年,有研究显示,身体活跃的母亲所生的男孩在数学和语言测试中的得分高于久坐不动的母亲所生的男孩(J Matern Fetal Neonatal Med, 29:1414–20)。

长期以来,科学家们一直认为,运动引起的后代改变本质上属于表观遗传。2015年,一个课题组报告,三个月的体育锻炼改变了年轻男性精子的DNA甲基化模式,这种改变与精神分裂症、帕金森症和其他脑部疾病相关基因有关(Epigenomics, doi: 10.2217/epi.15.29)。
澳大利亚Florey神经科学与心理健康研究所的Anthony Hannan和同事们观察了经常跑跑轮或其他体育锻炼的小鼠的精子。研究小组表明,运动刺激了雄性小鼠生殖系统细胞中几种小RNAs表达水平变化。众所周知,包装进入配子的小RNAs可影响后代代谢和学习记忆能力。父亲的这些精子变化让他们的雄性后代焦虑水平降低。这项研究的结论是,父母锻炼对后代的情绪健康有跨代影响(Transl Psychiat, 7:e1114, 2017)。
今年早些时候,德国神经再生疾病中心的实验神经病理学家André Fischer等人发表了一项有说服力的研究,丰富环境对大脑的益处会通过表观遗传方式加以传递。研究小组把成年雄性小鼠关在有丰富玩具的笼子里,而它们的堂兄弟姐妹则住在没有跑轮和玩具的笼子里。结果显示,丰富环境促使小鼠突触连接增加,并且它们的后代的学习速度也稍快一些。尽管这些差异在统计学上没有显著性(Cell Rep, 23:P546–54, 2018),但是通过分析父鼠精子,研究人员鉴定出两种microRNAs——miR212和 miR132,它们都与神经元发育有关,似乎影响着后代的认知能力。
目前尚不清楚这些发现是否适用于人类,但是Fischer和同事在论文中写道:这些结果对生殖医学可能是重要的。
处方运动
一些研究显示,体育锻炼可以抵消携带APOE-ε4等位基因个体患阿尔兹海默症的高风险,最近研究认为,运动能够对抗疾病相关大脑退化。
2018年,van Praag与哈佛医学院、麻省理工、麻省总医院、Dana-Farber癌症研究所和Salk研究所的同事们一起发表了一项小鼠研究,因为运动(并非服用神经保护性药物或通过基因疗法)过表达WNT3蛋白逆转了痴呆迹象。对比在跑轮上定期运动的小鼠,研究人员发现,服用神经保护性药物和人工过表达Bdnf基因但是未运动的小鼠的认知能力改善程度,二者竟然是相当的。证明治疗神经退行性疾病的最大障碍可能是患者运动不足。
这项研究为正在进行的58项有关运动、认知和阿尔兹海默症的临床试验提供了支持,另一方面,有100项调查正在探索运动在减轻帕金森症中的作用,还有数百项将运动视为抑郁症干预手段的测试,甚至还有一些研究学者正在测试锻炼对衰老的影响。
“积极的生活方式不会把70岁的大脑变成30岁,”Petzinger说。“但是研究运动对神经系统的影响,我们可以找到维持人类大脑健康最佳和最有效的策略,无论是单独运动还是配合药物运动等等。”
参考文献:
1. H. Maejima et al., “Exercise and low-level GABAA receptor inhibition modulate locomotor activity and the expression of BDNF accompanied by changes in epigenetic regulation in the hippocampus,” Neurosci Lett, 685:18–23, 2018.
2. H. van Praag et al., “Running increases cell proliferation and neurogenesis in the adult mouse dentate gyrus,” Nat Neurosci, 2:266–70, 1999.
3. H. van Praag et al., “Running enhances neurogenesis, learning, and long-term potentiation in mice,” PNAS, 96:13427–31, 1999.
4. A. Collins et al., “Exercise improves cognitive responses to psychological stress through enhancement of epigenetic mechanisms and gene expression in the dentate gyrus,” PLOS ONE, 4:e4330, 2009.
5. S.F. Sleiman et al., “Exercise promotes the expression of brain derived neurotrophic factor (BDNF) through the action of the ketone body β-hydroxybutyrate,” eLife, 5:e15092, 2016.
6. H.Y. Moon et al., “Running-induced systemic cathepsin B secretion is associated with memory function,” Cell Metab, 24:332–40, 2016.
7. B.E. Fisher et al., “Exercise-induced behavioral recovery and neuroplasticity in the 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine–lesioned mouse basal ganglia,” J Neuro Res, 77:378–90, 2004.
8. B.E. Fisher et al., “Treadmill exercise elevates striatal dopamine D2 receptor binding potential in patients with early Parkinson’s disease,” NeuroReport, 24:509–14, 2013.
9. W.A. Toy et al., “Treadmill exercise reverses dendritic spine loss in direct and indirect striatal medium spiny neurons in the 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine (MPTP) mouse model of Parkinson’s disease,” Neurobiol Dis, 63:201–09, 2014.
10. S.H. Choi et al., “Combined adult neurogenesis and BDNF mimic exercise effects on cognition in an Alzheimer’s mouse model,” Science, 361:eaan8821, 2018.


{replyUser1} 回复 {replyUser2}:{content}