世界首例免疫艾滋病的基因编辑婴儿在中国诞生
当中国科学家 2015 年首次在实验室编辑人类胚胎基因时,引发了全球科学家的强烈抗议和恳求。至少当时这些被改造的生命并没有真正出生。
但是现在,这似乎已经发生了。
据人民网 11 月 26 日报道,来自中国深圳南方科技大学的贺建奎团队,在第二届国际人类基因组编辑峰会召开前一日突然宣布,一对名为露露和娜娜的基因编辑婴儿已经于 11 月在中国健康诞生。消息发出后引发全球学界震动。
这对双胞胎的一个基因经过修改,使她们出生后即能天然抵抗艾滋病。这是世界首例免疫艾滋病的基因编辑婴儿,也意味着中国在基因编辑技术用于疾病预防领域实现历史性突破。
首个 HIV 免疫基因编辑婴儿
据中国临床试验注册中心本月在线发布的文件显示,贺建奎团队之前一直在招募志愿者夫妇,以创建第一批基因编辑的婴儿。
在这次的研究中,贺建奎的团队首先通过辅助生殖技术实现人类胚胎的体外受精,随后采用 CRISPR-Cas9 基因编辑技术对受精卵的 CCR5 基因进行基因编辑。CCR5 是 CCR5 基因编码的一种蛋白质,定位于白细胞表面,作为去化因子的受体而与免疫系统相关。在 T 细胞与特定组织和靶器官结合过程中发挥作用,具有调控 T 细胞核单核细胞或巨噬细胞系的迁移、增殖与免疫的功能。
相关研究信息显示,CCR5△32 缺失的个体拥有正常的免疫功能和炎症反应,能对多种病毒感染表现出显著的抵抗力。也就是说,通过对 CCR5 进行基因编辑或将有效阻断霍乱、天花或艾滋病的感染。
根据临床试验文件中的描述,研究人员将使用 CRISPR 基因编辑技术来修饰人类胚胎基因,然后将其移植到女性子宫中代孕发育。
临床试验数据也显示,研究人员将会对胎儿进行长达 24 周或 6 个月的基因检测。外界之前也一直猜测,这些移植的胚胎是否被终止妊娠,或者还是已经出生。
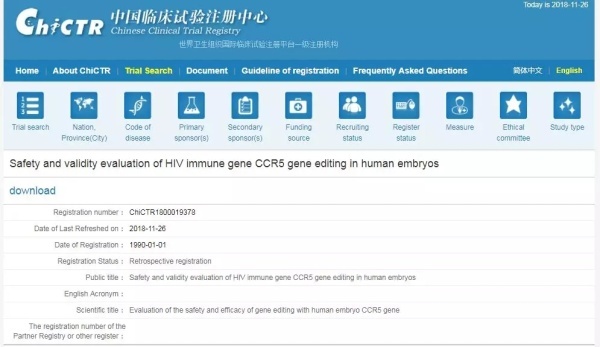
图丨贺建奎团队此次实验的相关注册资料(来源:中国临床试验注册中心)
对于贺建奎和中国说,第一批基因定制人类的诞生将是一项令人惊叹的医学成就,但它也会引起巨大的争议。有人认为这是一种消除遗传性疾病的新型治疗手段,也有的人认为这将开启一种全新形式的优生学,能够设计、改造婴儿。
“在基因编辑应用日益激烈的全球竞争中,我们希望能够脱颖而出,”贺建奎团队在去年提交的道德声明中写道。他们认为他们的这种创新将超越 2010 年荣获诺贝尔奖的体外受精技术。

图丨第二届国际人类基因组编辑峰会(来源:麻省理工科技评论)
第二届国际人类基因组编辑峰会将于 2018 年 11 月 27-29 日在香港举办。该峰会会期预计三天,由香港科学院、英国伦敦皇家学会、美国国家科学院和美国国家医学院联合举办。第一届国际人类基因组编辑峰会曾于 2015 年在华盛顿特区举办。
这项国际会议的目的就是帮助确定人类是否应该开始对自己进行基因编辑,以及如何监管和实施。
但本次国际峰会主席,加州理工学院的生物学家 David Baltimore 在为 11 月 27 日会议预先录制的信息中说道,“我们从来没有做过任何会改变人类基因的事情,而且我们从来没有做过任何会产生影响的事情。”
显然,国际峰会的组织者也对贺建奎的计划一无所知。
科学家的顾虑与担忧
对人类胚胎的基因编辑,意味着将会带来重大风险,包括引入不需要和未知突变的风险。
基因编辑科学家、西雅图非营利组织 Altius 生物医学科学研究所副主任 Fyodor Urnov 表示,他仔细研究了那些临床试验文件,虽然不完整,但确实表明贺建奎团队努力的目的是培养一个经过基因编辑的人类。
Urnov 表示,基因编辑是一种强大而且价值极大的技术,但是如果将其应用到人类胚胎,可能会给让近十年来在对成人和儿童进行基因编辑以治疗现有疾病方面取得的进展蒙上阴影。
(来源:麻省理工科技评论)
2017 年,在美国冷泉港实验室发布的一个科学报告中,贺建奎描述了一系列关于老鼠、猴子和 300 多个人类胚胎的初步基因编辑实验。CRISPR 的一个风险是它可能引入偶然或“脱靶”突变,但他当时声称胚胎检测显示很少或没有不必要的变化。
但是在 2017 年的一个演讲中,贺建奎也承认如果第一个 CRISPR 婴儿不健康,可能会成为一场灾难。“我们应该缓慢而谨慎地做到这一点,因为单一的失败案例可能会扼杀整个领域,”他说。
目前,使用基因编辑胚胎建立妊娠发育在欧洲大部分地区都是非法的,在美国也是禁止的。根据 2003 年中国政府发布的关于试管婴儿的指导文件,也是禁止这种做法的。但目前尚不清楚贺建奎是否得到特别许可或无视指导。
(来源:麻省理工科技评论)
舆论态度和道德风险
不久前,中山大学一研究团队发布了国内首份针对普通公众和 HIV 携带者关于基因编辑认知的比较报告,超六成受访者对基因编辑技术的运用持积极态度。575 份 HIV 携带者问卷显示,有 94.78% 的 HIV 携带者支持基因编辑技术用于预防 HIV。
另据美国皮尤研究中心 2018 年 4 月针对 2537 名美国成年人的一项调查显示,60% 的美国人支持对未出生婴儿进行基因编辑,认为为了降低患严重疾病的风险,基因编辑是一种有效的医疗手段。
但即便如此,贺建奎选择修改 CCR5 基因的做法也可能会引起争议,因为 CCR5 基因是 HIV 病毒入侵机体细胞的主要辅助受体之一,没有这种基因的人被认为对艾滋病病毒的感染具有高度免疫力。然而,为了在胚胎中模拟同样的结果,贺建奎的团队用 CRISPR 技术使原本正常的胚胎发生变异,从而破坏 CCR5 基因。
除了强调疾病治疗之外,新的技术难免不会让人联想到打造出完美后代的“定制婴儿”计划。所幸到目前为止,专家们一致认为基因编辑不应该被用来改变婴儿的外表或性格。
贺建奎似乎预料到了他的研究可能引起的担忧,于是去年 11 月他在微信朋友圈发文称,“我支持基因编辑用于治疗和预防疾病,但并不赞同为了提高或改善智商,那对社会没有好处。”
此前资料显示,在北欧人群里面有约 10% 的人天然存在 CCR5 基因缺失,但在中国却没有发现。这说明了基因工程可能会被用来挑选不同地方的人在长期进化过程中所获得的最“有用”的特点,并通过基因编辑的手段将它们集中在未来的孩子身上。例如,那些从未患过阿尔茨海默症、心脏病或某些传染病的幸运儿就可以“教会”其他人。
值得一提的是,贺建奎还会以一种历史的角度来看待技术的变革,“根据达尔文的进化论,数十亿年来,生命在不断进化。”但近几百年来,工业化彻底改变了环境,向人类提出了巨大的挑战,在这种情况下,人类可以用强大的工具来控制进化,“通过纠正疾病基因……我们人类可以更好地生活在快速变化的环境中。”
尽管如此,敲除 CCR5 基因来产生抗艾滋病毒的能力可能并不能成为改变婴儿遗传特征的强有力理由。毕竟还有更简单、更便宜的方法来预防艾滋病毒感染。此外,在体外受精过程中编辑胚胎成本高、技术含量高,而且在世界上艾滋病病毒猖獗的许多贫困地区仍然无法获得该技术。
注定载入史册的一次研究
资料显示,贺建奎现为南方科技大学副教授。他本科毕业于中国科学技术大学,后留学美国,在莱斯大学取得博士学位,并在斯坦福大学做博士后研究,师从微流控基因芯片鼻祖斯蒂文·奎克。在美期间,他与诺贝尔奖得主安德鲁. 菲尔、美国科学院院士马克. 戴维斯共同从事人体基因检测技术开发多年。
贺建奎本人拥有多学科交叉的背景,在基因测序仪研究、CRISPR 基因编辑,生物信息学等领域取得多项硏究成果。在美国斯坦福大学斯蒂文·奎克实验室从事博士后研究期间,他曾研发出免疫组库基因检测技术,并发表在国际顶尖学术杂志 Science 杂志的 Science Translational Medicin 上。
2012 年,贺建奎经深圳市“孔雀计划”海外高层次人才计划引进回国,在南方科学技术大学建立个人实验室进行基因测序方向的研究,其创办的瀚海基因公司也于 2017 年宣布成功研制出拥有完全自主知识产权的第三代基因测序平台 GenoCare。当时,随着国产第三代基因测序仪 Genocare 的正式上市,贺建奎和他的团队开始以行业黑马的形象走到众人面前。2018 年 4 月,瀚海基因完成 2.18 亿元人民币的 A 轮融资。
在人类基因编辑领域,尽管贺建奎领导的团队成果卓著,世界领先,但对于所有的科学家来说,并非所有人都报以祝贺的态度,因为这关乎的不仅仅是技术,还有一条道德的红线。
这不是一种简单的体细胞编辑,而是可以随着生殖细胞,遗传到后代,进而对种系进化造成影响的不可逆的编辑。没有人知道编辑后新诞生的生命将会面对什么,但毫无疑问,人类进化的命运将由此开始改变。
什么是道德的?这是一个悬于所有科学家胸口一个无法解开的问题。
如果在一个婴儿还不能决定自身命运的时候替他做出决定,但又无法替他分担可能面临的风险,这是否是道德的?
如果明知道一种方法可能会改变一个家族遗传疾病婴儿的命运却视而不见,束手旁观,这又一定算得上是道德的幺?
但如果开放人类胚胎基因编辑,那么是否是一种将起跑线提升到受精卵阶段的威胁呢?如果父母拥有更多的财富、权利,那将意味着他们的孩子有更多的机会“编辑”选择更美好的特质。
太锋利的刀作为工具,同样会伤人。对于新生事物,兴奋和恐惧是人类难以避免的两种复杂情绪,兴奋于新事物的迷人魅力,但又不知这种魅力是否也闪耀着死亡的光芒。
就像当初的试管婴儿,极端的人群甚至将其视为一种亵渎生命的技术,而今,世界首个试管婴儿已经 40 岁了,而她也早已有了属于自己的健康的孩子。
此时此刻,与试管婴儿一样也不一样,我们无法预知这两个婴儿将会面临如何的命运,但毫无疑问,贺建奎和他的团队已经注定要被写入了人类历史中了。


图丨团队的伦理审查书
参考资料:
EXCLUSIVE: Chinese scientists are creating CRISPR babies
来源:DeepTech深科技
版权及免责声明:本网站所有文章除标明原创外,均来自网络。登载本文的目的为传播行业信息,内容仅供参考,如有侵权请联系答魔删除。文章版权归原作者及原出处所有。本网拥有对此声明的最终解释权。


{replyUser1} 回复 {replyUser2}:{content}