原研药与仿制药:长路险阻,捷径多艰
首先,恭喜山争哥哥凭借《我不是药神》拿下金马影帝!
好的电影,好的文艺作品,不应只是“看热闹”式的狂欢,它们更反映出一定的社会现实,或发人深省,或振聋发聩。
《我不是药神》这部电影,讲述了一个印度神油的小贩为慢粒白血病人代购印度仿制药“格列卫”的故事,也将原研药和仿制药之间的矛盾推上了风口浪尖。
贯穿其中的一个主要矛盾是,如果仿制药在疗效上并不输于原研药,为什么仿制药那么便宜,原研药却那么贵?
我们先不直接回答这个问题,先来看看在真实世界里医生是如何选择的呢?
虽然一直强调仿制药在治疗效果上与原研药不相上下,但是根据美国对151名临床医生的一项临床报告显示,60%的医生认为仿制药会导致更多的不良反应。同样法国一项对300多名从业医生的调查研究也显示,80%的医生认为仿制药最大的优点是节约医疗成本,认为仿制药能够真正和原研药起到相同作用的人只有1.6%,而认为仿制药具有和原研药相同的安全性的人数为0。
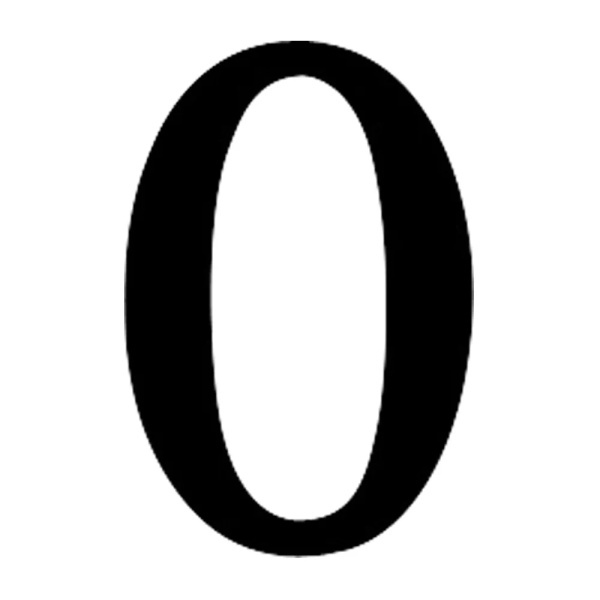
是的,就是0。
但即使如此,全球仿制药市场规模依然超过2000亿美元(2016年),在中国,仿制药的一致性评价是2018年国家药品监督管理局的重点推进项目。仿制药之所以备受瞩目,“前途光明”,追根结底,还是价格问题。电影中的原研药2万块一瓶,而印度仿制药只需要500块。
那么,究竟是什么造成了原研药和仿制药之间巨大的价格差异?仿制药和原研药对比少做了哪些工作?而用于评判仿制药的原则又是什么?
接下来以抗血小板药物替格瑞洛为例,详细给大家拆解原研药仿制药之间的差异。
路漫漫其修远兮,十几年的上下求索
截止到2018年,心血管疾病仍然是全球第一大死亡病因。绝大多数的急性冠状动脉综合征(ACS)是动脉粥样硬化斑块不稳定的结果,而不断被激活、募集的血小板就是造成动脉粥样硬化斑块不稳定的主要原因。于是,抑制血小板聚集成为治疗和预防心血管疾病的重要途径。
科学家发现了ADP受体P2Y1,血小板表面的P2Y12和ADP结合,可以促进血小板的释放反应,所以通过阻滞P2Y12,可以有效阻止血小板的聚集。
P2Y12受体阻滞剂——氯吡格雷应运而生了。这是一种前体药物,需要经过肝酶代谢才能发挥作用,起效慢,还受到患者基因型的制约。
研究人员试图找到一款不受基因型限制、方便服用的抗血小板药物。合成的化合物既要与P2Y12亲和,又要有良好的代谢特性,总之缝缝补补,总共有6000个类似物被合成,然后又在动物实验中被无情抛弃。最终得到的化合物AZD6140可以有效识别ADP,与P2Y12受体的亲和力增加超过1000倍,并且和P2Y12受体的结合是可逆的。
在细胞实验中,AZD6140表现出了对人P2Y12受体强有力地可逆结合。在小鼠实验中,AZD6140表现出对P2Y12介导的小鼠血管收缩的抑制作用。
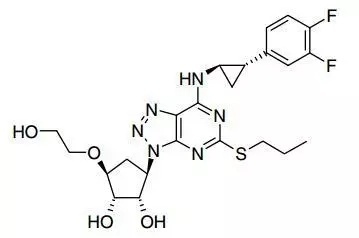
化合物 AZD6140
同时,AZD6140在血栓小鼠模型、糖尿病小鼠模型和动脉瘤小鼠模型中都降低了血栓形成。种种实验现象显示,AZD6140除了可以抑制血小板聚集之外,还可能保护患者免受再灌注损伤。
动物实验的成功意味着临床前实验部分终于告一段落。但是,对于新药的研发来说,只是走了不到一半的路程。接下来,是更加漫长更加磨人的临床试验。
Ⅰ期临床试验主要是对药物进行初步的临床药理学及人体安全性评价,说白了,就是这个药物进入人体之后是如何被吸收、分布、代谢和排出的,同时也要观察人体对试验药物的耐受和不良反应。
虽然要求Ⅰ期临床试验的受试者为20-30例,但是AZD6140的Ⅰ期临床试验前后大约有950名受试者(此时该称呼为替格瑞洛了)。受试者单次口服替格瑞洛200mg,药品在1.5小时内被迅速吸收。
Ⅱ期临床试验是初步评价药品治疗作用的阶段。一般会采用双盲随机平行对照试验,受试者被提供两种外观一致的试验药和对照药,为之后的给药剂量方案提供依据。
替格瑞洛的Ⅱ期临床试验病例前后已经超过了1000例。对比血小板抑制剂中的“前任老大”氯吡格雷,替格瑞洛表现出了更加优秀的治疗效果。在服药第一天,氯吡格雷对血小板的抑制作用没有超过15%,而替格瑞洛的抑制作用达到了80%-90%。同时,替格瑞洛也显示出了另一个优点,因为它直接阻滞P2Y12受体,不像氯吡格雷那样需要经过肝酶代谢,所以不会受到相关基因多态性的影响。
Ⅲ期临床试验的主要目的是确证治疗作用。在这一阶段中,试验药物对目标适应症患者的治疗作用和安全性被进一步验证,一般是临床试验中最大规模的样本量,为药物注册申请审查提供充分的依据。
替格瑞洛的Ⅲ期临床试验,招募的志愿者人数达到18624例。接受替格瑞洛治疗的患者180mg负荷剂量,之后每日两次90mg维持剂量,接受氯吡格雷治疗的患者300-600mg负荷剂量,之后每天75mg维持剂量。药物的中位暴露时间为277天,主要终点为心血管死亡、心梗和卒中。
替格瑞洛的治疗优势在30天后开始变得明显,并且持续整个研究过程。接受替格瑞洛治疗的患者,各项死亡率和全因死亡率均低于接受氯吡格雷的患者,这也是第一个出现如此显著的全因死亡率降低的抗血小板药物。
此外,包含31个国家21162例患者的PEGASUS-TIMI 54研究结果2015年发表在《新英格兰杂志》上,包含10个国家3799例患者的TREAT研究结果2018年发表在《美国心脏病学会杂志》上,这些大型临床试验都证明了替格瑞洛治疗ACS的安全性和有效性。
为了进一步确认替格瑞洛对亚洲ACS患者的治疗效果,中国解放军总医院、天津医科大学总医院的学者们在2013年开始了针对中国ACS患者的后羿研究,还有针对中国21个省市2004例患者的大禹研究。这些研究在新药上市之后开展,属于应用研究阶段的Ⅳ期临床试验,考察在广泛使用条件下的药物疗效和不良反应。而试验结果也再一次证明了替格瑞洛的安全性和有效性。
走过艰难的原研研发之路,替格瑞洛终于迎来了自己的“身份证”。
2011年7月20日,FDA批准替格瑞洛治疗急性冠状动脉综合征。
同年,替格瑞洛写入美国AHA/ACCF二级预防指南,写入加拿大CCS门诊患者抗血小板治疗应用指南。
2012年,替格瑞洛写入欧洲ESC心血管疾病预防指南。
2015年,替格瑞洛写入中国STEMI指南。
2015年9月3日,美国食品和药品管理局批准替格瑞洛扩大适应症,包括长期用于有心梗病史的高危患者。
截止到2018年11月,替格瑞洛的临床试验还在继续,相信经过科学家们的不断努力,替格瑞洛可以对更多的适应症起到治疗效果,为更多心脑血管的健康保驾护航。
仿制药,到底仿的是啥?
在《我不是药神》的原型事件发酵的时候,知乎有个评论得到了很多的点赞——“靶向药之所以昂贵到要卖几万元,那是因为你能买到的已经是第二颗药了,第一颗药的价格是数十亿美金”。
看完上面原研药的研发过程,你肯定理解了上面那句话。
实际上,在1984年之前,无论是原研药,还是仿制药,都要走完前面介绍的“漫漫长路”。
1962年,由于“反应停”等事件的影响,美国FDA出台了《卡法尔-哈里斯修正案》,严格要求上市的药品,不论是原研药还是仿制药,都必须进行药物临床的安全性和有效性研究。

“反应停”(沙利度胺)治疗了孕妇怀孕早期的呕吐,但是也造成了无数的婴儿畸形
《卡法尔-哈里斯修正案》可谓是把双刃剑,一方面让药物安全性和有效性有了保障,避免了类似反应停之类事件再次发生;另一方面让创新药企和仿制药企业不得不加大研发投入,背上了沉重的研发成本包袱。造成了普通患者买不起高价“原研药”,也买不到低价“仿制药”的局面。
不过,更受伤的还是仿制药生产企业。他们要么没有足够的资金支撑临床研究,要么是花了不少钱做了临床研究,却没有了价格优势。
在这样的情况下,再去做仿制药就是真傻了。甚至很多原研药在过了专利保护期后,仍然没有仿制药上市。既然没有仿制药的竞争,创新药企还创新啥啊,守着几个原研药,就可以“吃一辈子”了,于是整个药物研发产业陷入了一个恶性循环。
这样一来,患者和仿制药生产商肯定不干了。
1984年,在多方面的压力下,美国通过了《Hatch-Waxman法案》,仿制药只需要证明和已有原研药的“生物等效性”就可以申请上市,极大地简化了仿制药的审批程序,这无疑提高了仿制药的市场竞争力。与此对应的,原研药的专利期得到了一定时间的延长,用以弥补新药审批所耗费的专利时限。
《Hatch-Waxman法案》既平衡了患者利益与药品制造商的利益,也平衡了原研创新和仿制药竞争之间的利益,被认为美国医药产业百年发展历史中具有里程碑意义。
那么,被规范了之后的仿制药是如何诞生的呢?
既然是“仿制”,那对对照药品的研究肯定是不能少的。通过对原研样品的检测,仿制药厂商开始探究处方工艺。原研药品的主要成分信息可以通过各种渠道获得,其他一些辅料的成分配比并不要求和原研样品完全相同。得到的小样需要和原研产品进行影响因素对比,这个环节不要求涉及全部影响因素,基本上选用主要成分的敏感因素进行实验即可。
经过两次扩大生产并质量检测合格之后,仿制药的原辅料和组成和生产工艺基本就可以确定下来,到这一步,仿制药研发花费的时间大约在6个月左右。
而且,仿制药研究不要求进行药理毒理学的临床试验,只需要将相关文献资料进行整理就可以了。
溶液剂的仿制药可以免去临床试验,而固体口服制剂的仿制药需要证明和原研药品具有生物等效性,研究只需要18-24例受试者。
生物等效性是指人体中仿制药品的吸收程度和速度与原研药品的差异。一般认为,仿制药和参比原研药的生物利用度差异在-20%-+25%以内,都可以认为二者具有生物等效性,可以成功通过质量检测。
直到仿制药申报生产,时间为10-12个月。
仿制药不需要选择靶点和筛选化合物,用生物等效性来代替原研药研发阶段的细胞实验、动物实验和大样本临床试验,节省了时间和科研成本,价格低廉也是意料之中。
但是,被判定为生物等效,仿制药就可以完全达到和原研药相同的临床效果吗?
生物等效性实验的成功证明仿制药的血药浓度和原研药基本等效,但是影响药物疗效的因素可多了去了,单单一个血药浓度并不足以保证相同的治疗效果。
参与临床等效性研究的受试者不仅人数较少,人群也多为18-40岁的健康男性,生理特征和疾病风险较高的老人、儿童等并不相同。药物真正的疗效与安全性,只有在大样本的临床实际应用中才能够得到证实。
对于某些特殊的药物类别或者药物剂型,达到生物等效性并不完全意味着它们达到了和对照药品相同的治疗效果。此外,生物等效性可接受的微小误差,可能会影响到某些复杂的药物传递机制,导致不能达到相同的治疗效果。在万古霉素制剂的原研药和仿制药的对比中,虽然药品在体外实验中都表现出了相似的抑菌活性,但是所有受试的仿制药都没能杀灭粒细胞减少的小鼠大腿感染模型中的金黄色葡萄球菌。
有研究人员表示,目前的数据强调了需要提高仿制药进入市场的监管准则,而不是仅仅通过简单“生物等效性”进行评价。“生物等效性”这一评价标准不涉及质量和患者安全性的重要问题。若使用仿制药,则必须采用过滤技术和光学显微镜对其进行测试,以确保其不存在特别是小颗粒污染,并确保其纯度可靠。
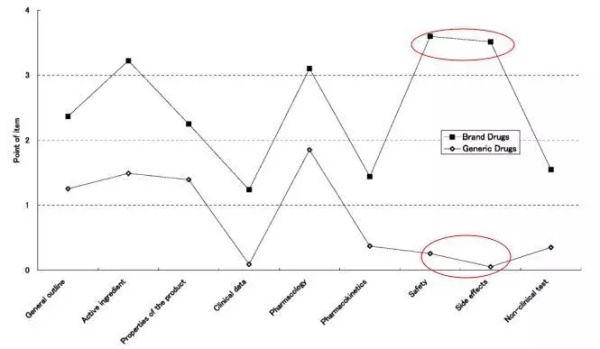
日本临床医生对原研药和仿制药的评价调查研究
日本学者曾经向524家医疗机构发放了调查问卷,获得临床医生对原研药和仿制药的评价。可以看到,仿制药的各项得分普遍低于原研药,尤其是在“安全性”和“不良反应”这两项中,简直被原研药“虐杀”。
在对中国临床医生的调研中,情形也相差无几。近95%的医生认为原研药在质量稳定性、药物副反应等方面都要优于仿制药。
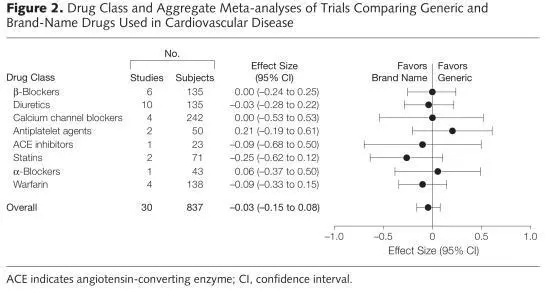
仿制药与原研药相比,不通过的药物治疗效果差异较大[18]
无论如何,原研药和仿制药都为人类的健康做出了贡献;而且随着一致性评价的严格执行,仿制药的质量也在不断地提高,我们也期待真正质优价廉的仿制药。
参考资料:
[1] Riner, Béatrice, Bussy, Adèle, Hélène-Pelage, Jeannie, et al. “No generics, Doctor!” The perspective of general practitioners in two French regions[J]. BMC Health Services Research, 2017, 17(1):707.
[2]徐培红, 刘天尧, 干荣富. 医药新政下我国制药行业发展的新思路[J]. 中国医药工业杂志, 2018,49(1):1624-1628.
[3] Springthorpe B, Bailey A, Barton P, et al. From ATP to AZD6140: the discovery of an orally active reversible P2Y12 receptor antagonist for the prevention of thrombosis.[J]. Bioorganic & Medicinal Chemistry Letters, 2007, 17(21): 6013-6018.
[4] Flierl U , Sch.Pp C , Jaitner J , et al. The novel P2Y12 antagonist AZD6140 rapidly and reversibly reduces platelet activation in diabetic rats[J]. Thrombosis Research, 2010, 125(3).
[5] Bjorkman J A , Kirk I , Giezen J J V . AZD6140 inhibits adenosine uptake into erythrocytes and enhances coronary blood flow after local ischemia or intracoronary adenosine infusion[C]// Scientific Session of the American-heart-association. 2007.
[6] Teng R , Oliver S , Hayes M A , et al. Absorption, Distribution, Metabolism, and Excretion of Ticagrelor in Healthy Subjects[J]. Drug Metabolism & Disposition the Biological Fate of Chemicals, 2010, 38(9):1514-1521.
[7] Storey R F , Thornton S M , Lawrance R , et al. Ticagrelor yields consistent dose-dependent inhibition of ADP-induced platelet aggregation in patients with atherosclerotic disease regardless of genotypic variations in P2RY12, P2RY1, and ITGB3[J]. Platelets, 2009, 20(5):8.
[8] Wallentin L , Becker R C , Budaj A , et al. Ticagrelor versus clopidogrel in patients with acute coronary syndromes.[J]. New England Journal of Medicine, 2009, 361(11):1045-1057.
[9] Bonaca M P, Bhatt D L, Cohen M, et al. Long-Term Use of Ticagrelor in Patients with Prior Myocardial Infarction.[J]. The New England Journal of Medicine, 2015, 372(19): 1791-1800.
[10] Berwanger O, Nicolau J C, Carvalho A C, et al. Ticagrelor vs Clopidogrel After Fibrinolytic Therapy in Patients With ST-Elevation Myocardial Infarction: A Randomized Clinical Trial[J]. JAMA Cardiology, 2018, 3(5): 391-399.
[11] Chen Y , Dong W , Wan Z , et al. Ticagrelor versus clopidogrel in Chinese patients with acute coronary syndrome: A pharmacodynamic analysis.[J]. International Journal of Cardiology, 2015, 201:545-546.
[12] Gao R , Wu Y , Liu H , et al. Safety and Incidence of CardiovACSular Events in Chinese Patients with Acute Coronary Syndrome Treated with Ticagrelor: the 12-Month, Phase IV, Multicenter, Single-Arm DAYU Study[J]. CardiovACSular Drugs and Therapy, 2018.
[13] Vesga O , Agudelo M , Salazar B E , et al. Generic Vancomycin Products Fail In Vivo despite Being Pharmaceutical Equivalents of the Innovator[J]. Antimicrobial Agents and Chemotherapy, 2010, 54(8):3271-3279.
[14] 刘旭亮, 张立颖, 臧恒昌. 仿制原料药研究开发流程及技术要求[J]. 齐鲁药事, 2009, 28(12): 746-749.
[15] James K C , Rangoonwala R , Reshetnykov M , et al. Non-Equivalence of Antibiotic Generic Drugs and Risk for Intensive Care Patients[J]. Pharmaceutical Regulatory Affairs Open Access, 2013.
[15] Iijima H , Kamei M , Koshimizu T , et al. Objective evaluation of generic drug information[J]. Yakugaku Zasshi-journal of the Pharmaceutical Society of Japan, 2004, 124(6):341-347.
[16] 邵蓉, 唐吉锋, 施孝金, et al. 总额预付制下医保费用管理措施对医疗服务行为影响[J]. 中国医院管理, 2016, 36(7):19-22.
[17] Kesselheim A S, Misono A S, Lee J L, et al. Clinical equivalence of generic and brand-name drugs used in cardiovascular disease: a systematic review and meta-analysis.[J]. JAMA, 2008, 300(21): 2514-2526.
[18]Kesselheim A S, Misono A S, Lee J L, et al. Clinical equivalence of generic and brand-name drugs used in cardiovascular disease: a systematic review and meta-analysis.[J]. JAMA, 2008, 300(21): 2514-2526.
文章来源:奇点网


{replyUser1} 回复 {replyUser2}:{content}