史上最全!121个仿制药一致性评价通过品规汇总
据GBI SOURCE数据库显示,截至11月28日,CDE有关仿制药一致性评价累计受理号已达598个,涉及218家企业的185个品种,总计通过品规121个。其中9月、10月仿制药一致性评价受理号均达81个,截至28日,11月份受理号数量已达71个。在此,GBI SOURCE数据库带你详细了解仿制药一致性评价11月进度情况(数据统计截至11月28日)。
一、11月新增通过仿制药一致性评价品规
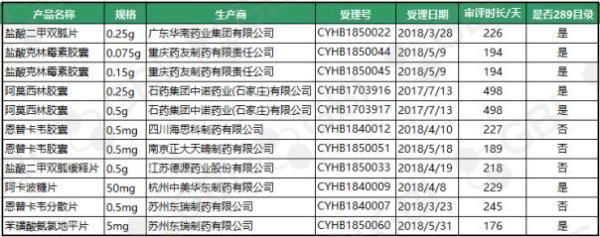
截至11月28日,11月份新增11个品规通过仿制药一致性评价。其中:
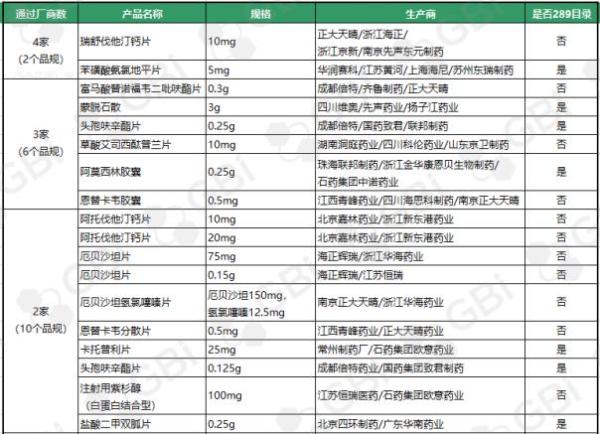
● 7个品规为289目录品种,详见上表;
●随着苏州东瑞制药苯磺酸氨氯地平片(5mg)通过仿制药一致性评价,苯磺酸氨氯地平片(5mg)成为继瑞舒伐他汀钙片(10mg)之后第二个仿制药一致性评价通过企业达4家的品规;
●石药集团中诺药业阿莫西林胶囊(0.25g、0.5g)两个规格通过仿制药一致性评价,也使得阿莫西林胶囊(0.25g)成为又一个仿制药一致性评价通过企业达3家的品规;
●四川海思科制药、南京正大天晴,加之之前通过的江西青峰药业,恩替卡韦胶囊(0.5 mg)成为仿制药一致性评价通过企业达3家的又一品规。
二、11月新增视同通过仿制药一致性评价品规
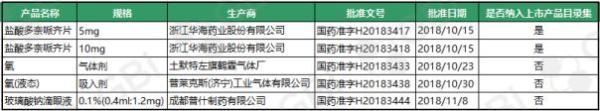
另据GBI SOURCE数据库显示,截至11月28日,11月份新增视同通过仿制药一致性评价品规5个,其中浙江华海药业盐酸多奈哌齐片(5mg、10mg)已被纳入《中国上市药品目录集》。
三、仿制药一致性评价通过企业达3家及以上品规
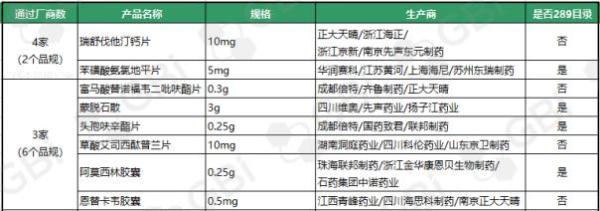
截至目前,通过仿制药一致性评价或视同通过仿制药一致性评价的121个品规中通过企业达 3 家及以上品规已有8 个。其中:
●瑞舒伐他汀钙片(10mg)、苯磺酸氨氯地平片(5mg)2个品规目前已有4家企业通过仿制药一致性评价;
●通过企业达 3 家的6个品规分别是:
富马酸替诺福韦二吡呋酯片(0.3g)
蒙脱石散(3g)
头孢呋辛酯片(0.25g)
草酸艾司西酞普兰片(10mg)
阿莫西林胶囊(0.25g)
恩替卡韦胶囊(0.5 mg)
四、仿制药一致性评价总体进展
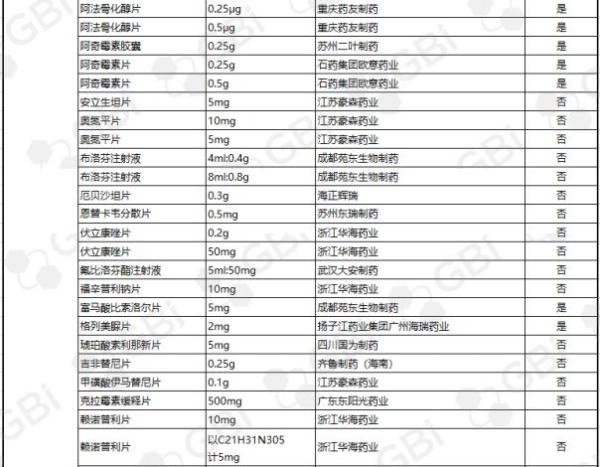
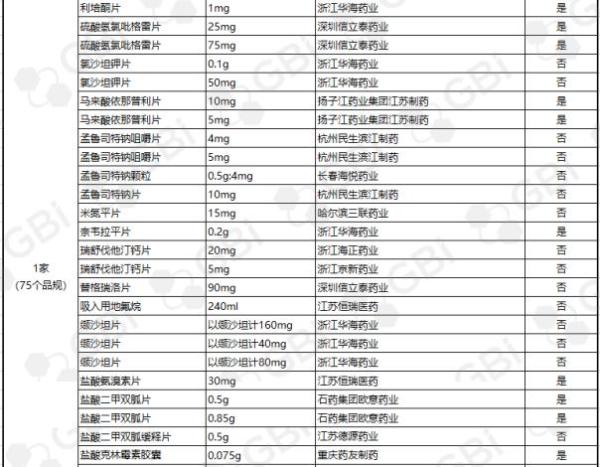
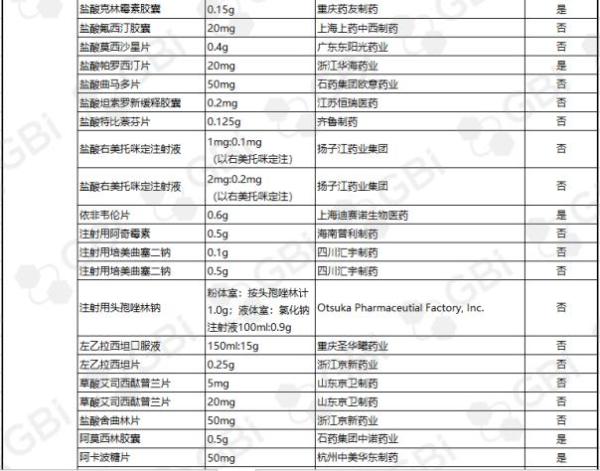
据GBI SOURCE数据库显示,截至11月28日,CDE有关仿制药一致性评价累计受理号已达598个,涉及218家企业的185个品种。目前已有121个品规通过或视同通过仿制药一致性评价,41个品规包含在289目录,289目录通过率约为14.2%(详细名单见下表)。其中:
●2个品规通过企业达 4 家
●6个品规通过企业达 3 家
●10个品规通过企业达2家
●75个品规通过企业达1家
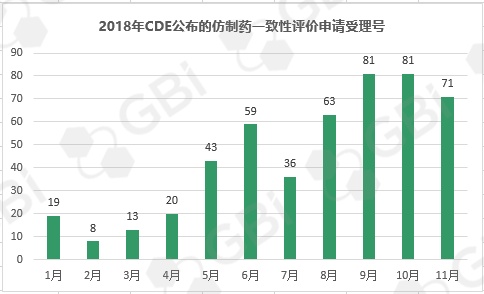
五、2018年CDE受理仿制药一致性评价变化趋势
据GBI SOURCE数据库【药品申报情况统计】工具统计的结果显示,11月份CDE新受理了 71 个(数据统计截至11月28日)仿制药一致性评价的申请。截至目前,CDE有关仿制药一致性评价累计受理号已达598条,涉及218家企业的185个品种。其中9月、10月仿制药一致性评价受理号均达81个。由此可见,临近2018年底大限,第三季度以来企业申报仿制药一致性评价的积极性明显增高。
此外,近期有媒体报道一些未能按时通过一致性评价的企业抱团呼吁“放宽期限”。对此,专业人士认为,289目录在整个化学药品类中占比不过6%-7%,不会对用药造成影响,而一旦无条件延期,不仅违背了提高药品质量的初衷,而且对于已经投入资金和精力去做评价的企业不公平,影响其他企业做一致性评价的积极性。同时,该专业人士还强调,需要考虑到愿意和能够承担生物等效性(BE)试验的临床试验机构数量不足、部分仿制药的参比制剂仍未公的现状,企业只要开始申报,就可以同等对待,至于不申报的,那就等同于放弃了。
来源:新浪医药
版权及免责声明:本网站所有文章除标明原创外,均来自网络。登载本文的目的为传播行业信息,内容仅供参考,如有侵权请联系答魔删除。文章版权归原作者及原出处所有。本网拥有对此声明的最终解释权。


{replyUser1} 回复 {replyUser2}:{content}