Sci Adv:科学家开发出真正意义上的新型HIV疫苗!
近日,一项刊登在国际杂志Science Advances上的研究报告中,来自斯克利普斯研究所的科学家们克服此前HIV疫苗开发的技术障碍开发出了一种新型的HIV候选疫苗,在动物实验中这种新型疫苗能刺激动物机体产生一种强大的抗HIV抗体反应;研究者表示,这种新型疫苗策略的开发基于HIV的包膜蛋白Env,此前研究人员很难利用Env蛋白开发刺激机体出现特殊免疫力的疫苗。
图片来源:Jiang Zhu/Scripps Research
这项研究中,研究人员发现了一种简单的方法,其能将Env蛋白的结构稳定在理想的形状,甚至是多种不同的HIV毒株;通过利用病毒样颗粒来模仿整个HIV病毒,稳定的Env就能诱发小鼠和兔子机体出现强大得抗HIV抗体反应,目前基于该策略的候选疫苗正在猴子机体中进行测试。研究者Jiang Zhu教授表示,这种新型策略有望解决科学家们长期在开发HIV疫苗上遇到的问题。
HIV表面Env蛋白能帮助病毒牢牢抓住宿主细胞并开启感染过程,由于Env蛋白在感染过程中扮演着关键角色,而且其也是最多暴露于感染宿主机体免疫系统中的关键病毒结构,因此该蛋白常常会作为研究人员开发HIV疫苗的主要靶点,研究人员的想法就是将整个Env蛋白或其亚单位接种到人类机体中来刺激产生与Env结合的抗体,而利用这些抗体或有望抑制HIV后期再次感染宿主。
当然,截至目前为止,在大型的临床试验中研究人员并未开发出有效的HIV疫苗,很多研究者认为,在HIV感染宿主细胞之前,如果能将Env蛋白呈递给宿主免疫系统或许就能使得开发出的HIV有效发挥作用;但科学家们在准确呈递Env蛋白上常常会面临巨大挑战。在HIV中,Env会以紧密的三聚体结构突触病毒外膜,在感染细胞之前以及感染细胞后,这些复杂的结构都会从根本上调整形状,尽管进行了大量研究,科学家们依然无法找到一种广泛适用的方法将Env三聚体稳定成为一种理想的感染前形状。
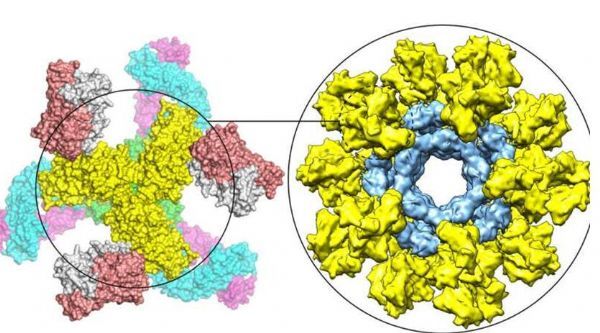
研究者Zhu说道,到目前为止研究人员报道过一些稳定HIV三聚体的方法,但无法进行推广,Env三聚体的亚稳定性被认为是开发HIV疫苗的核心问题。这项研究中,研究人员表示,他们所开发的新方法的确能针对多样化的HIV毒株中的Env三聚体发挥作用,这种“未分割预融合优化”方法(UFO,uncleaved prefusion-optimized approach)能将Env的结构稳定成为一种闭合的形状,如今研究者就能对30-40种HIV堵住的Envs进行修饰,通过将稳定的Env三聚体(每次最多能达到60个)与单个纳米颗粒相连接,研究人员就能优化HIV的疫苗策略,单个纳米颗粒能模仿整个HIV病毒的球体结构。通过这种方式开发的疫苗分子虽然是人工合成的,但在免疫学角度来看,其却非常像一种真正入侵的病毒,并能刺激机体产生更强的反应。
通过对小鼠进行研究后,研究者发现,在仅仅8周时间里,这种附着Env的纳米粒疫苗就能释放出抗体,成功中和天然循环的HIV毒株。研究者Zzhu说道,这项研究中我们首次在小鼠机体中利用候选疫苗诱导出理想类型的抗体反应,同时我们还在兔子机体中也观察到了相似的结果,这就表明,这种基于纳米颗粒的方法明显优于利用分离Env蛋白所开发的疫苗策略。
后期研究人员将在24只猴子体内进行后期的试验,如今研究人员正在测试来自不同HIV毒株中的两种基于Env三聚体的候选疫苗,同时还对一种由三种基于Env的疫苗混合而成的候选疫苗进行测试。本文中研究人员所开发的新方法或是过去艾滋病疫苗研究30年以来真正意义上的突破性成果。
原始出处:
Linling He, Sonu Kumar, Joel D. Allen,et al. HIV-1 vaccine design through minimizing envelope metastability, Science Advances (2018). DOI: 10.1126/sciadv.aau6769


{replyUser1} 回复 {replyUser2}:{content}