深度解读:非编码RNA是如何促进疾病发生的
长期以来,人们一直认为DNA储存遗传信息,蛋白质是生命活动的执行者,而RNA仅仅是将遗传信息从DNA传递给蛋白质的中间分子。但是,随着人类基因组计划的完成,科学家们惊讶的发现,可以编码蛋白质的基因只有25000个左右,仅占基因组序列的2%,而98%基因组序列都是非蛋白编码区,包含DNA复制和基因表达调控元件以及大量的非编码RNA基因(指一类以非编码RNA为终产物的基因)。非编码RNA因为没有经典的蛋白开放阅读框(ORF),在基因组中难以被识别和鉴定,被称为基因组的“暗物质”,小部分被鉴定到的非编码RNA也被认为是转录的噪声,不具有生物学功能。
2003年,由美国牵头启动的“人类DNA元件百科全书计划”(ENCODE)显示,大约80%的人类基因组序列可以被转录,随后,不同种类,功能各异的非编码RNA被相继鉴定出来,人们惊讶的发现:非编码RNA的数目远远大于蛋白编码基因的数目,它们绝不是转录中的噪声和垃圾。
那么,人类为什么会有数量如此庞大的非编码RNA基因呢?这些非编码RNA在生命活动中又扮演了怎样的角色,发挥了什么功能呢?除了早期已知的rRNA, tRNA, snRNA和snoRNA之外, 近年来研究比较热门的小非编码RNA(sncRNA)、长非编码RNA(lncRNA)和环状RNA(circRNA)等都得到了大规模的鉴定. 在sncRNA中, 研究较为透彻的包括microRNA, siRNA和与Piwi蛋白互作的RNA (piRNA)三大类。这些非编码RNA虽然不编码蛋白,但是却以RNA的形式参与了多种细胞活动,包括基因的激活和沉默,RNA的剪接、修饰和编辑,蛋白质的翻译等(下图),而非编码RNA在疾病,特别是在肿瘤发生和转化过程中的作用,一直是该研究领域的重点和热点。
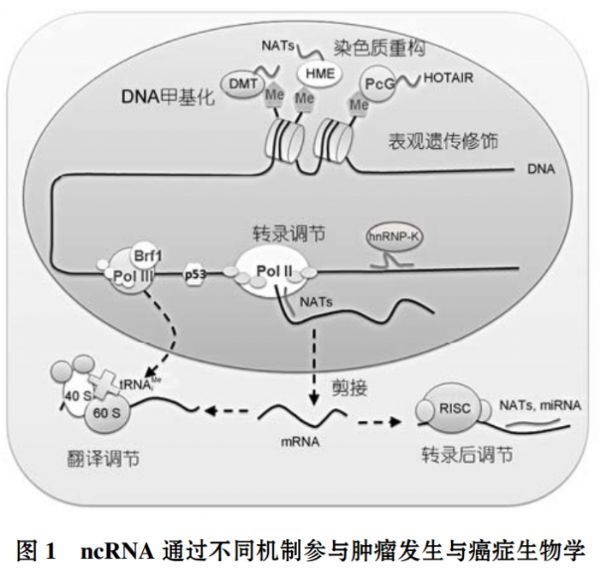 我国的非编码RNA研究开展时间较早,建立了良好的基础和体系,近年来也有一系列成果登上学术界顶级期刊,走在了国际非编码RNA研究的前列,也涌现了一批RNA研究的学术带头人。四川大学生命科学学院的宋旭教授和第二军医大学的孙树汗教授都是非编码RNA与肿瘤研究领域的领军人物。下面,小编就通过梳理以上两位教授的研究,为大家阐述非编码RNA是如何促进疾病发生的。
我国的非编码RNA研究开展时间较早,建立了良好的基础和体系,近年来也有一系列成果登上学术界顶级期刊,走在了国际非编码RNA研究的前列,也涌现了一批RNA研究的学术带头人。四川大学生命科学学院的宋旭教授和第二军医大学的孙树汗教授都是非编码RNA与肿瘤研究领域的领军人物。下面,小编就通过梳理以上两位教授的研究,为大家阐述非编码RNA是如何促进疾病发生的。
 宋旭博士(上图)是四川大学生命科学学院教授、博士生导师、 “ 蛋白质机器与生命过程调控”国家重点研发计划首席科学家、四川省千人计划专家、四川省遗传学会理事长、中国遗传学会常务理事。宋旭博士1999年在美国耶鲁大学做博士后,之后升任Associate Research Scientist,Research Assistant Professor,2006年回国后,在四川大学任职,一直致力于研究长非编码RNA与蛋白质的相互作用,以及该相互作用在肿瘤发生发展中的意义。其中于2004年发现哺乳动物逆转座子非编码RNA具有基因调控作用,提出了逆转座子非编码RNA通过与蛋白质相互作用发挥功能的机制,这也是长非编码RNA-蛋白质相互作用参与肿瘤发生发展过程的最早报道。近年来,自主建立了筛选与目标蛋白质相互作用的长非编码RNA的技术平台(RNA—SELEX-seq),为长非编码RNA筛选及功能研究提供了重要技术手段;发现多种长非编码RNA可通过与蛋白质相互作用调控多个靶基因从而参与肿瘤发生发展过程。
宋旭博士(上图)是四川大学生命科学学院教授、博士生导师、 “ 蛋白质机器与生命过程调控”国家重点研发计划首席科学家、四川省千人计划专家、四川省遗传学会理事长、中国遗传学会常务理事。宋旭博士1999年在美国耶鲁大学做博士后,之后升任Associate Research Scientist,Research Assistant Professor,2006年回国后,在四川大学任职,一直致力于研究长非编码RNA与蛋白质的相互作用,以及该相互作用在肿瘤发生发展中的意义。其中于2004年发现哺乳动物逆转座子非编码RNA具有基因调控作用,提出了逆转座子非编码RNA通过与蛋白质相互作用发挥功能的机制,这也是长非编码RNA-蛋白质相互作用参与肿瘤发生发展过程的最早报道。近年来,自主建立了筛选与目标蛋白质相互作用的长非编码RNA的技术平台(RNA—SELEX-seq),为长非编码RNA筛选及功能研究提供了重要技术手段;发现多种长非编码RNA可通过与蛋白质相互作用调控多个靶基因从而参与肿瘤发生发展过程。
 孙树汉博士(上图),第二军医大学遗传学国家重点学科、基础部医学遗传学教研室主任,全军医学遗传学重点实验室主任、遗传研究所所长。孙树汉博士长期致力于肝脏病理生理的研究,已在cancer cell,Hepatology和Nature Cell Biology等期刊发表论文多篇。
孙树汉博士(上图),第二军医大学遗传学国家重点学科、基础部医学遗传学教研室主任,全军医学遗传学重点实验室主任、遗传研究所所长。孙树汉博士长期致力于肝脏病理生理的研究,已在cancer cell,Hepatology和Nature Cell Biology等期刊发表论文多篇。
孙树汉教授的最新成果刊登在了Nature Cell Biology上,题为“The MBNL3 splicing factor promotes hepatocellular carcinoma by increasing PXN expression through the alternative splicing of lncRNA-PXN-AS1”。
可变剪接作为一种转录后调控的机制,可以使同一个基因产生不同的mRNA和蛋白质,在肿瘤的增殖,凋亡,转移和耐药等多个方面均发挥了重要作用。虽然癌症中发生可变剪接的mRNA很多,但是长非编码RNA在可变剪接中是否发挥作用,还是未知的。孙教授以致死性强,恶性程度高的肝癌为模型,研究剪接因子MBNL1在其中的作用。
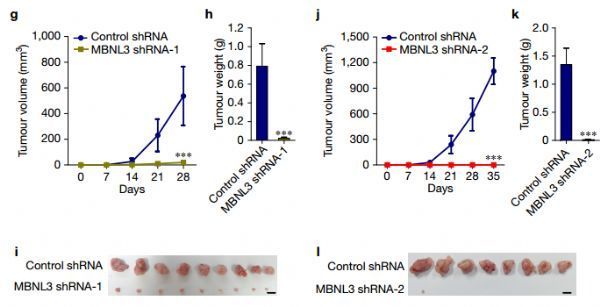
早期的研究发现MBNL1在肝癌中显着高表达,通过体内体外的表型实验,研究者发现敲低MBNL1几乎可以消灭肿瘤细胞。(下图)
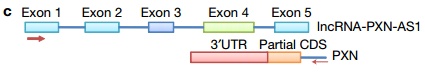
 通过RNA测序的方法,研究者找到了一系列在敲低MBNL3后低表达的基因,通过GO聚类分析,发现调控细胞增殖的基因下降最明显,这和敲低MBNL3的表型是一致的。同时,研究者鉴定了一系列在敲低MBNL3后发生可变剪接的长非编码RNA,其中包括lncRNA-PXN-AS1。lncRNA-PXN-AS1是基因PXN的反义链长非编码RNA,且其第4外显子与PXN的3‘UTR互补。在敲低MBNL3后,lncRNA-PXN-AS1的第4外显子被剪切掉,成熟的lncRNA-PXN-AS1不包含第4外显子。(下图)
通过RNA测序的方法,研究者找到了一系列在敲低MBNL3后低表达的基因,通过GO聚类分析,发现调控细胞增殖的基因下降最明显,这和敲低MBNL3的表型是一致的。同时,研究者鉴定了一系列在敲低MBNL3后发生可变剪接的长非编码RNA,其中包括lncRNA-PXN-AS1。lncRNA-PXN-AS1是基因PXN的反义链长非编码RNA,且其第4外显子与PXN的3‘UTR互补。在敲低MBNL3后,lncRNA-PXN-AS1的第4外显子被剪切掉,成熟的lncRNA-PXN-AS1不包含第4外显子。(下图)
 那么,lncRNA-PXN-AS1第4外显子的去留,对该长非编码RNA的功能有什么影响呢?要知道,大量的测序数据发现反义非编码RNA与其临近基因有明显的共表达趋势,所以对于反义长非编码RNA的研究,大多集中在in cis的调控方式上。而孙老师在此提出了一个全新的理论——反义长非编码RNA可在细胞质中影响原临近基因的mRNA的稳定性和翻译效率。
那么,lncRNA-PXN-AS1第4外显子的去留,对该长非编码RNA的功能有什么影响呢?要知道,大量的测序数据发现反义非编码RNA与其临近基因有明显的共表达趋势,所以对于反义长非编码RNA的研究,大多集中在in cis的调控方式上。而孙老师在此提出了一个全新的理论——反义长非编码RNA可在细胞质中影响原临近基因的mRNA的稳定性和翻译效率。
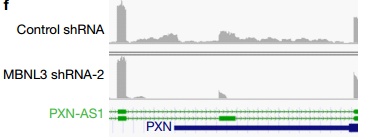 在干扰MBNL3后,缺少第4外显子的lncRNA-PXN-AS1(命名为PXN-AS1-S)与PXN mRNA的CDS区结合,阻碍翻译延伸因子,使其从mRNA上脱落,进而抑制了PXN基因的翻译。而在MBNL3存在的情况下,lncRNA-PXN-AS1的第4个外显子得以保留(命名为PXN-AS1-L),并通过与PXN的3‘UTR的碱基互补配对结合,阻碍mir-24于PXN 3‘UTR的结合,从而促进PXN mRNA的稳定性和翻译。(下图)
在干扰MBNL3后,缺少第4外显子的lncRNA-PXN-AS1(命名为PXN-AS1-S)与PXN mRNA的CDS区结合,阻碍翻译延伸因子,使其从mRNA上脱落,进而抑制了PXN基因的翻译。而在MBNL3存在的情况下,lncRNA-PXN-AS1的第4个外显子得以保留(命名为PXN-AS1-L),并通过与PXN的3‘UTR的碱基互补配对结合,阻碍mir-24于PXN 3‘UTR的结合,从而促进PXN mRNA的稳定性和翻译。(下图)
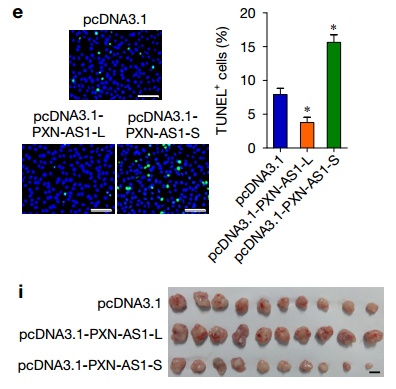
 那么,lncRNA-PXN-AS1的第4外显子的去留,是否能决定细胞的命运呢?研究者通过表型实验,发现PXN-AS1-S(无第4外显子)可以促进肿瘤细胞的生长,而PXN-AS1-L(有第4外显子)可以抑制肿瘤细胞的生长。(下图)
那么,lncRNA-PXN-AS1的第4外显子的去留,是否能决定细胞的命运呢?研究者通过表型实验,发现PXN-AS1-S(无第4外显子)可以促进肿瘤细胞的生长,而PXN-AS1-L(有第4外显子)可以抑制肿瘤细胞的生长。(下图)
 看完分享,大家是否觉得非编码RNA的研究神奇且多样,希望了解更多研究故事和细节呢?大福利来啦!2017(第五届)非编码RNA研讨会于10月27日-28日在上海举办,届时宋旭教授和孙树汉教授均会亲临现场,小伙伴们还不赶紧报名一睹两位教授的风采!
看完分享,大家是否觉得非编码RNA的研究神奇且多样,希望了解更多研究故事和细节呢?大福利来啦!2017(第五届)非编码RNA研讨会于10月27日-28日在上海举办,届时宋旭教授和孙树汉教授均会亲临现场,小伙伴们还不赶紧报名一睹两位教授的风采!
参考文献:
1. 刘顺, 屈良鹄. 人类基因知多少. 科学通报, 2017, 62: 619–625
2. 宋旭. 长非编码RNA参与肿瘤发生发展过程. 2012年全国生物化学与分子生物学学术大会。
3. Ji-hang Yuan. Shu-han Sun. et al. The MBNL3 splicing factor promotes hepatocellular carcinoma by increasing PXN expression through the alternative splicing of lncRNA-PXN-AS1. Nature cell biology. https://www.nature.com/ncb/journal/v19/n7/pdf/ncb3538.pdf

{replyUser1} 回复 {replyUser2}:{content}