中国学者Science破解寨卡病毒感染导致小颅畸形的奥秘
寨卡病毒病患者的症状可能包括轻微发热、皮疹、结膜炎、肌肉和关节疼痛、浑身虚弱或头痛等。当寨卡病毒在美洲(主要是巴西)一些国家爆发时,当地会出现大量患有小头畸形的婴儿出生,并且这些婴儿的母亲许多已经感染了寨卡病毒。2016年,军事医学研究院秦成峰研究员与中科院遗传发育所许执恒研究员率先在Cell Stem Cell上发表论文证明了寨卡病毒感染直接导致小头畸形。然而,寨卡病毒如何演变为可导致小头畸形的致命病毒,科学界一直缺乏合理的解释。9月28日,秦成峰课题组与许执恒课题组再次合作在Science上在线发表了题为“A single mutaion in the prM protein of Zika virus contributes to fetal microcephaly”的论文,首次发现了一个位于寨卡病毒prM蛋白中关键位点(单个氨基酸突变S139N即可显著增加寨卡病毒的神经毒力),从病毒层面揭示了寨卡病毒感染导致小头畸形的分子机制。此外,对于寨卡病毒致病机制研究和疫苗药物的研发亦具有重要指导意义。
 论文解读:
论文解读:
寨卡病毒(Zika virus)一种古老的虫媒病毒,最早于1947年分离于乌干达的Zika森林故而得名。在随后的60多年中,由于寨卡病毒感染患者的临床症状均较为轻微,并没有引起广泛关注。2007 年开始,寨卡病毒在东南亚地区和太平洋岛国不断出现较大规模暴发流行,并伴随出现格林巴利综合症综合等严重疾病;尤其是2015年进入美洲以后,寨卡病毒感染导致的神经系统疾病,尤其是新生儿小头畸形(Microcephaly)的发病率急剧上升,引起全世界的广泛关注,被世界卫生组织宣布为“全球关注的突发公共卫生事件”【1,2】。
小头畸形,也即小头症,是一种严重的神经发育障碍疾病,患者脑部发育不全,智力低下,终身不能生活自理,给患者、家庭和社会带来沉重负担(下图)。2016年以来,世界各国科学家围绕寨卡病毒的生物学特征、致病机制以及疫苗、药物等开展了一系列研究,并取得了重要进展。然而,寨卡病毒究竟如何从一个无人关注的“普通”病毒,演变为可导致小头畸形的致命病毒,科学界一直缺乏合理的解释。
 小头畸形患者。图片来源于网络
小头畸形患者。图片来源于网络
2016年寨卡病毒输入我国以后,军事医学研究院病原微生物生物安全国家重点实验室秦成峰团队立刻开展科研攻关,先后从我国输入性病例体内分离获得了一系列不同来源的寨卡病毒,并通过与中科院遗传所许执恒课题组合作,成功建立了寨卡病毒的胎鼠动物模型,证实了寨卡病毒感染与小头畸形的直接关联(下图)【3】。
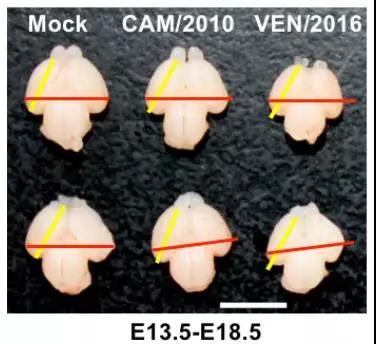
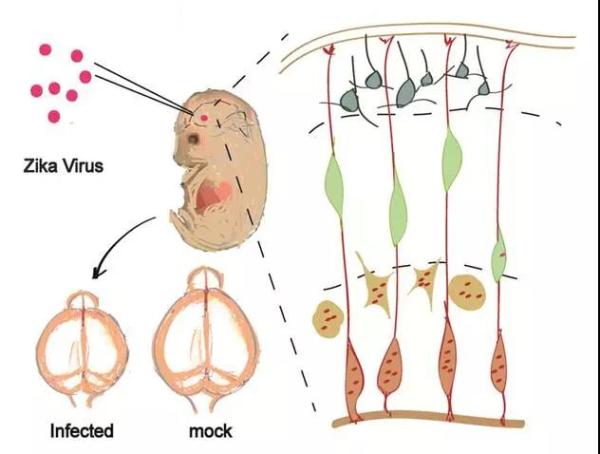 在上述研究的基础之上,他们首先比较了不同来源寨卡病毒的乳鼠神经毒力,结果发现2015-2016年期间分离自委内瑞拉、萨摩亚和马提尼克的寨卡病毒株的神经毒力均显著强于2010年柬埔寨分离株。尤为重要的是,在胚胎期13.5天(E13.5)的胎鼠模型中,委内瑞拉分离株VEN/2016导致胎鼠小头畸形的能力明显强于柬埔寨分离株CAM/2010(下图),尤其在鼠神经前体细胞(Neuro progenior cells; NPC)中,委内瑞拉分离株VEN/2016增殖和诱导细胞凋亡的能力更强,其导致的NPC增殖和分化更异常更为严重。
在上述研究的基础之上,他们首先比较了不同来源寨卡病毒的乳鼠神经毒力,结果发现2015-2016年期间分离自委内瑞拉、萨摩亚和马提尼克的寨卡病毒株的神经毒力均显著强于2010年柬埔寨分离株。尤为重要的是,在胚胎期13.5天(E13.5)的胎鼠模型中,委内瑞拉分离株VEN/2016导致胎鼠小头畸形的能力明显强于柬埔寨分离株CAM/2010(下图),尤其在鼠神经前体细胞(Neuro progenior cells; NPC)中,委内瑞拉分离株VEN/2016增殖和诱导细胞凋亡的能力更强,其导致的NPC增殖和分化更异常更为严重。
 为了进一步确定导致不同寨卡病毒流行株致病力差异的决定位点,研究人员对全部寨卡病毒株基因组全序列进行了深入的生物信息学分析,结果发现与2010年柬埔寨分离株相比,当前寨卡病毒流行株发生了一系列氨基酸突变,其中7个氨基酸位点保守性较高且稳定存在于当前流行株中(下图)。因此,研究人员将分别将上述7个突变位点分别引入寨卡病毒的感染性克隆中,利用反向遗传学技术拯救获得了相应的突变病毒。
为了进一步确定导致不同寨卡病毒流行株致病力差异的决定位点,研究人员对全部寨卡病毒株基因组全序列进行了深入的生物信息学分析,结果发现与2010年柬埔寨分离株相比,当前寨卡病毒流行株发生了一系列氨基酸突变,其中7个氨基酸位点保守性较高且稳定存在于当前流行株中(下图)。因此,研究人员将分别将上述7个突变位点分别引入寨卡病毒的感染性克隆中,利用反向遗传学技术拯救获得了相应的突变病毒。
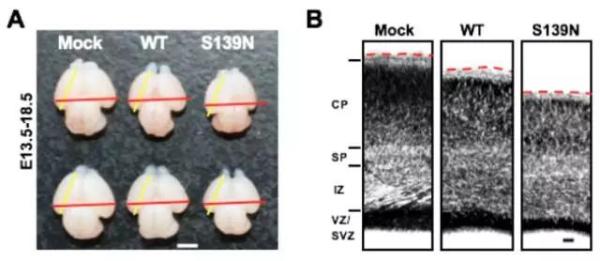
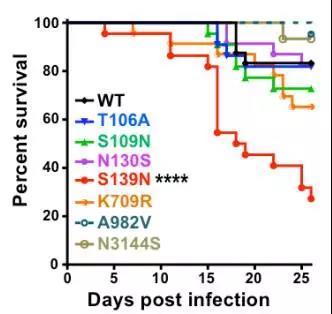 进一步的动物实验发现,携带S139N突变的寨卡病毒对乳鼠的致病力显著提高;如果在当前流行株中引入N139S回复突变则显著降低了病毒的神经毒力。同时,S139N突变病毒在E13.5胎鼠模型中也表现出更强的颅内复制能力和致小颅畸形能力;而且,在人神经前体细胞中S139N突变病毒也表现出更强的感染能力,导致更为严重的细胞死亡(下图)。
进一步的动物实验发现,携带S139N突变的寨卡病毒对乳鼠的致病力显著提高;如果在当前流行株中引入N139S回复突变则显著降低了病毒的神经毒力。同时,S139N突变病毒在E13.5胎鼠模型中也表现出更强的颅内复制能力和致小颅畸形能力;而且,在人神经前体细胞中S139N突变病毒也表现出更强的感染能力,导致更为严重的细胞死亡(下图)。
 进一步溯源分析发现,S139N突变最早出现于2013年5月的法属波利尼西亚流行株,而且在几乎所有2013年以后美洲和太平洋岛国分离株中该突变稳定存在,与寨卡疫情大暴发过程中大量新生儿小头急性病例的出现高度吻合。上述结果充分表明,寨卡病毒中S139N单氨基酸位点突变即可显著增强其对神经前体细胞的嗜性,进而导致更为严重的小头畸形。
进一步溯源分析发现,S139N突变最早出现于2013年5月的法属波利尼西亚流行株,而且在几乎所有2013年以后美洲和太平洋岛国分离株中该突变稳定存在,与寨卡疫情大暴发过程中大量新生儿小头急性病例的出现高度吻合。上述结果充分表明,寨卡病毒中S139N单氨基酸位点突变即可显著增强其对神经前体细胞的嗜性,进而导致更为严重的小头畸形。
总的来说,该研究首次发现了决定寨卡病毒神经毒力的关键位点,揭示了寨卡病毒靶向神经前体细胞导致小头畸形的分子机制。相关发现为寨卡疫情中小头畸形病例的突然出现提供了合理解释,为寨卡病毒的快速演化之谜的提供了直接答案。尤其是S139N突变位点的发现为今后的寨卡病毒的病原监测和风险预测提供了重要靶标,对于寨卡病毒致病机制研究和疫苗药物的研发亦具有重要指导意义。
据悉,军事医学研究院病原微生物生物安全国家重点实验室秦成峰研究员与中科院遗传发育所许执恒研究员为论文通讯作者,许执恒课题组袁玲、张峰、祝星亮,秦成峰课题组黄星耀、刘忠钰、于九洋为论文并列第一作者。美国德克萨斯大学医学分校史佩勇教授、中国科学院动物研究所胡宝洋研究员、生物物理研究所王祥喜研究员、泰山医学院史卫峰教授亦对本研究做出重要贡献。研究工作得到了国家重点研发计划、重大科技专项,基金委优秀青年基金、英国牛顿高级学者基金、创新群体基金,北京市脑计划等项目的支持。
专家点评:
安静 首都医科大学教授
Comments:寨卡病毒(zika virus,ZIKV)于1947年首先在乌干达发现,在此后的数十年里,ZIKV活动比较隐匿,仅在赤道附近有散发病例,且大多数感染者无明显临床症状。但自2013年以来,ZIKV首先在法属波利尼西亚暴发,随即迅速蔓延至南美。由于ZIKV感染与神经系统合并症密切相关,特别ZIKV能够跨胎盘传播引起胎儿小头畸形,引起了全球广泛关注。虽然自ZIKV暴发以来,全球科学家围绕病毒的生物学特征、致病机制以及疫苗、药物等开展了一系列研究,并取得了重要进展,但对于ZIKV神经毒力改变的分子机制尚无合理解释。日前,军事医学研究院秦成峰教授研究团队与中科院遗传发育所许执恒教授团队联合攻关,在Science发表题为“A single mutaion in the prM protein of Zika virus contributes to fetal microcephaly”的研究论文,从病毒层面阐明了ZIKV之小头畸形的分子机制。该研究发现:当前ZIKV流行株发生了一系列氨基酸突变,其中7个氨基酸位点保守性较高且稳定存在于当前流行株中。随即利用反向遗传学技术和动物实验,研究人员逐一证明上述7个突变位点在病毒致病中的作用,最终确定携带S139N突变的ZIKV对乳鼠的致小颅畸形能力显著提高,引入N139S回复突变则显著降低了病毒的神经毒力。进一步溯源分析发现,S139N突变最早出现于2013年5月的法属波利尼西亚流行株,且稳定存在于几乎所有的2013年以后美洲和太平洋岛国分离株中,与寨卡疫情大暴发过程中大量新生儿小头急性病例的出现高度吻合。该研究首次发现了决定ZIKV神经毒力的关键位点,揭示了ZIKV靶向神经前体细胞导致小头畸形的分子机制。
参考资料:
1、WHO.http://www.who.int/mediacentre/factsheets/zika/zh/
2、WHO. WHO Director-General summarizes the outcome of the Emergency Committee regarding clusters of microcephaly and Guillain-Barré syndrome. 2016 1 February 2016; Available from: http://www.who.int/mediacentre/news/statements/2016/emergency-committee-zika-microcephaly/en/.
3、Li, C., Xu, D., Ye, Q., Hong, S., Jiang, Y., Liu, X., ... & Xu, Z. (2016). Zika virus disrupts neural progenitor development and leads to microcephaly in mice.Cell stem cell, 19(1), 120-126.


{replyUser1} 回复 {replyUser2}:{content}