阿兹海默病研发报告:146次失败后,我们还能保持乐观吗?
阿兹海默病(AD)是最为常见的神经退行性疾病之一,其发病率随年龄上升而迅速增加。随着社会老龄化程度的加剧,这一疾病可能会带来日益严重的社会负担。不幸的是,AD在新药研发领域是难以逾越的险峰——过去的二十年里,有上百种充满希望的新药在临床试验中败下阵来,至今患者依旧缺乏有效的治疗方案。
近日,美国药品研究与制造商协会(PhRMA)发布了一份关于AD研发现状的报告,这份名为“开发阿兹海默病的药物:挫折和经验”的报告详细介绍了关于AD药物的历史和现状,探讨了开发中的需要解决的挑战,并指出虽然过去多年的结果都以失败居多,但仍有充分的理由保持乐观。
AD带来的社会负担
AD是一种在老年人中常见的神经退行性疾病,它导致大脑中神经细胞逐步受损死亡,造成患者的认知能力和其它大脑功能下降。患者首先会出现记忆方面的缺陷,随着症状恶化,他们逐渐丧失生活自理能力,给自身和家人都带来沉重的压力。AD在全世界约有2500万患者,单在美国就有大约570万患者,是美国排名第六的致死原因,在2010年至2015年期间,AD死亡人数增加了123%。
随着人均寿命延长,社会老龄化程度加剧,AD造成的社会负担可能会更加严重:如果不尽快开发出新的药物和疗法,到2050年,美国AD患者的总数预计将达到1380万,AD护理的直接成本将达到1.1万亿美元!如果能尽快开发一种新药,将AD的发病时间延迟五年,并在2025年就被批准使用的话,AD护理成本可以减少大约40%。因此,报告指出:“随着科学的进步,医生、立法者、患者代言人和行业领导者必须共同努力,确保我们为治疗做好准备。”
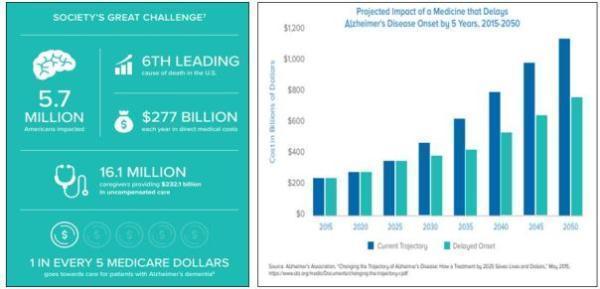
▲AD带来的社会负担(图片来源:参考资料[1])
目前对AD的了解
虽然世界各地的研究者在对AD进行广泛的研究,但AD背后的机制尚未完全阐明。迄今为止的研究显示了AD的两个标志性特征:淀粉样蛋白β(Aβ)的沉积和tau蛋白相关的神经原纤维缠结。
已知Aβ和Tau蛋白这两种蛋白质的功能障碍与AD发展有关。在健康大脑中,Aβ会被降解和消除,但是在AD患者的大脑中,Aβ失调可能导致大脑组织中的细胞外Aβ蛋白沉积。Tau蛋白也是正常人大脑中常见的蛋白,它能维持细胞的稳定。然而在病变的大脑中,错误折叠的tau蛋白会异常积聚,可能引起神经原纤维缠结和细胞死亡。这些变化会导致大脑功能受损。
在患者出现疾病迹象之前数十年,Aβ就已经在整个大脑中沉积,而tau蛋白则是在疾病后期开始蔓延,从颞叶扩展到大脑的其他部分。但要指出的是,研究者至今仍不清楚,Aβ沉积和Tau纠缠是AD的成因还是结果。
除了这两个标志,研究者也发现AD与基因突变有关。大约不到1%的AD病例是由编码淀粉样蛋白前体(APP),早老素1(presenilin 1)和早老素2(presenilin 2)这三个蛋白的基因出现突变导致。21号染色体三体综合征和其他基因突变也有可能导致AD。
除了遗传因素,环境和生活方式也有可能影响AD。有研究显示,日常锻炼和控制慢性病(糖尿病、肥胖、高血压等)有可能延缓认知能力下降和失智症(dementia)发展。
虽然AD目前尚无法治愈,但患者尽早接受正确诊断仍然很重要:一方面,患者可以被给予缓解症状的药物来改善生活品质,另一方面,确诊后可以鼓励患者进行体力活动,采取良好的饮食习惯和优化其他药物的剂量,来达到优化患者认知能力的效果。
有研究显示,患者在出现AD症状二十年之前,大脑就可能展现出跟AD相关的变化。因此,医学界试图通过多种手段来诊断AD患者,以及招募临床试验受试者。基于图像的诊断技术有正电子发射计算机断层扫描(PET),以及单光子发射断层扫描(SPECT)。不基于图像的诊疗手段主要是检测和分析来自于血液、尿液、脑脊液等样本中的生物标记物。
开发AD药物面对的挑战
开发AD药物对于全世界的研究者来说一直是个严峻的挑战。1998年至2017年间,开发AD药物的146次尝试都失败了,只有4种药物成功获批用于该疾病,成功与失败的比例为1:37。而那些成功药物的效果也并不尽如人意,它们只能减轻症状而不能根治疾病,并且目前用于减缓AD进展的药物也并不特别有效。因此许多研究者认为,不能把治疗AD的希望寄托在单一的药物上,而是应该考虑联合使用多种药物。
关于AD药物难以开发的原因,文章指出了以下几点:
对AD的成因和机制尚不清楚。有许多AD药物是靶向Aβ和tau蛋白的,但人们尚不清楚Aβ沉积和tau缠结是AD的成因还是结果,抑或是病情发展的标志。因此,找到真正有效的靶点是开发药物的重中之重。
缺乏有效的临床前模型。对于药物开发而言,有个合适的临床前模型用于测试药物,能在把药物推进至人体试验之前提供极有价值的信息。但对于AD这种影响认知的疾病来说,目前的AD动物模型并不完美,从中获取的信息难以直接应用于人类,因此限制了药物测试和对人体疗效预测的效果。
缺乏早期诊断模型。因为缺乏经过验证,非侵入性的生物标记物,现有的诊疗手段难以诊断AD早期患者,只有当AD症状十分严重时才能确诊,而此时的疾病已经进展到难以控制和治疗的程度了。并且,因为难以找到AD早期患者,临床试验难以招募到合适的受试者,或者测试找到的受试者要花费巨资,这些受试者也有可能难以坚持到试验结束。
报告指出,克服以上这几点才有可能将AD药物开发带上新的台阶。鉴于AD的复杂性,这需要医药企业、政府、学术研究机构、患者代言组织、疾病基金会等多方面共同努力。
AD药物开发的经验和教训
在1998年至2017年间,有146次不成功的尝试和4次成功。成功药物分别是Exelon(2000年,用于轻度至中度AD患者),Razadyne(2001年,用于轻度至中度AD患者),Namenda(2003年,用于中度至重度AD患者),Namzaric(2014年,用于中度至重度AD患者),加上之前的Aricept(1996年,用于各时期的AD患者),这些是为数不多的FDA批准用于AD的药物。
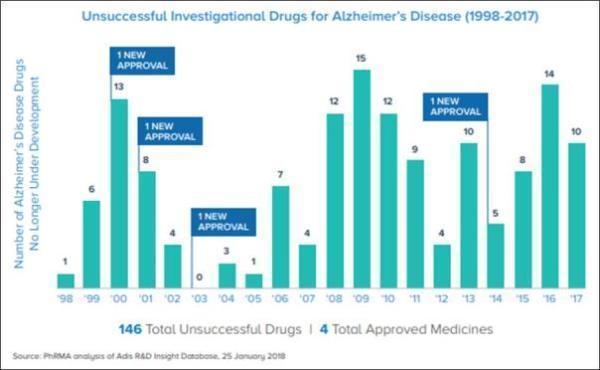
▲1998年至2017年间,AD药物开发结果(图片来源:参考资料[1])
在那146次不成功的尝试中,有40%的药物开发停止于临床0期至临床1/2期,有39%停止于临床2至2/3期,有18%停止于临床3期甚至监管审批期间,还有3%因为各种原因没有进一步开发。这些数字表明,有相当数量的药物已经达到了耗资巨大的临床开发后期,但最终未能成功,进一步凸显了AD药物开发过程的挑战性。
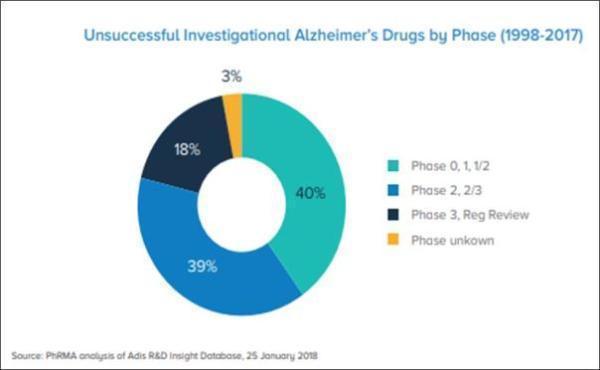
▲AD未成功在研药物终止阶段(图片来源:参考资料[1])
在研究过但未能获得最终成功的靶点中,很多是针对淀粉样蛋白信号通路的(15%),同时也有一部分是针对tau蛋白(4%)。截止于2016年3月,在已终止的研究中,试图减轻神经炎症(19%)和调节大脑神经传导信号(26%)的研究占了近一半。
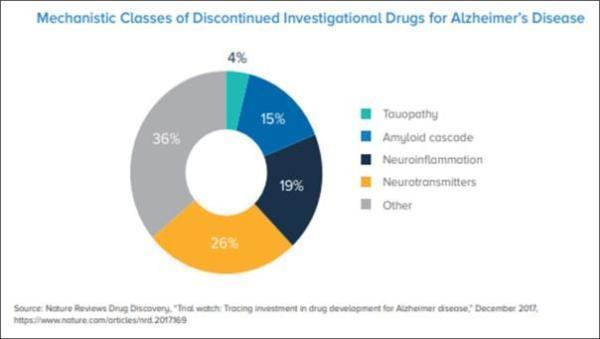
▲AD未成功在研药物机制分类(图片来源:参考资料[1])
当下的AD药物研发管线
虽然这些年的研究并未带来能从本质上改变AD治疗局面的药物,但人们对攻克AD的信心不减。自2000年以来,包括拜耳(Bayer)、礼来(Eli Lily)、葛兰素史克(GSK)、默沙东(MSD)、辉瑞(Pfizer)和其他33家公司在内的医药企业已经投入超过6000亿美元用于该领域研发,仅2017年一年就高达714亿美元。目前有大约92种针对AD和其他失智症的药物正处于临床2期和3期试验中,在这92种位于开发管线中的药物里,估计约有75%的药物有潜力成为改善疾病的新疗法!并且每天都有新的研究问世,扩展人们对AD的认识,因此有理由保持乐观。

▲2018年AD药物研发管线一览(图片来源:参考资料[3])
具体而言,在2018年有31种药物位于临床3期的评估中,其中有25种有潜力在未来5年中获批投放市场。这些药物中有12种是缓解症状的药物,也即用于减轻患者症状,包括烦躁、攻击性、失眠等情况;有19种是改变疾病进展的药物,也即试图调节造成AD的原因。以靶标来看,这31种药物中有14种是靶向神经传递过程的药物。
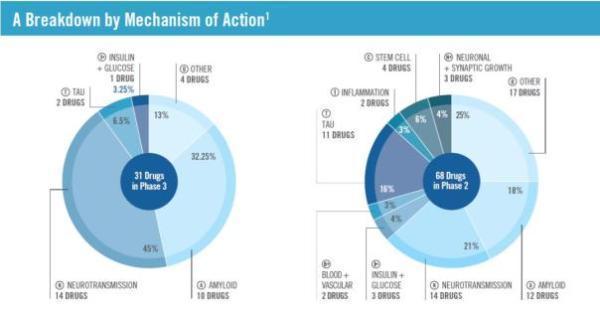
▲2018年AD药物研发管线作用机制分类(图片来源:参考资料[3])
在2018年处于临床2期的药物有68种,其中有8种有潜力在未来5年中获批投放市场。这些药物中有13种是缓解症状的药物,55种是改变疾病进展的药物。以目标来看,有11种靶向tau蛋白,12种靶向淀粉样蛋白。
总结
AD是一种给患者和社会都带来巨大压力的疾病,目前科学界尚未完全阐明AD的成因和机制,并且由于AD本身的潜伏性,以及缺乏合适的动物模型等原因,给新药开发和测试带来了极大挑战。
虽然过去二十年中针对AD的药物开发只有2.7%的成功率,但各界人士的信心历久弥坚,矢志攻克这种带来诸多痛苦的人类疾病。现在随着对于AD的认识逐步深入,有诸多药物正处于开发管线中,希望接下来的几年里有更多更好的AD药物面世,为患者带来实质性的改善。
参考资料:
[1] Alzheimer's Medicines: Setbacks and Stepping Stones
[2]New Report Expresses Optimism Over Current State of Alzheimer's Drug Development
[1]2018 ALZHEIMER’S DRUG PIPELINE THE CURRENT STATE OF ALZHEIMER’S DRUG DEVELOPMENT
来源:新浪医药
版权及免责声明:本网站所有文章除标明原创外,均来自网络。登载本文的目的为传播行业信息,内容仅供参考,如有侵权请联系答魔删除。文章版权归原作者及原出处所有。本网拥有对此声明的最终解释权。


{replyUser1} 回复 {replyUser2}:{content}