发现 > 资讯
FDA发布2018新药审批报告:首创新药35%
·
·
·
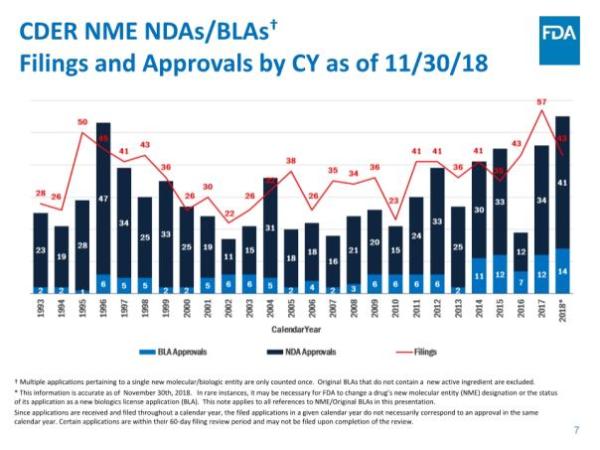
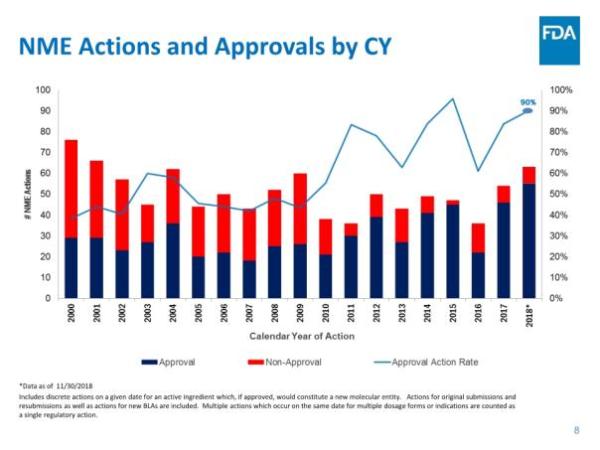
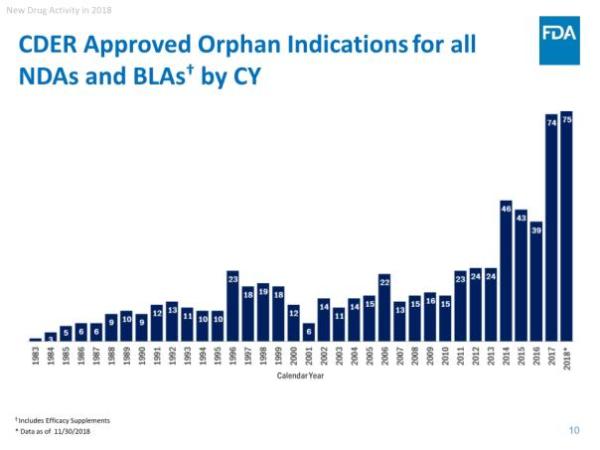
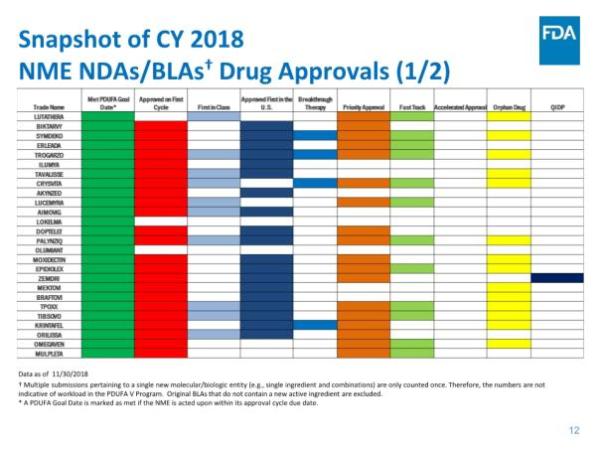
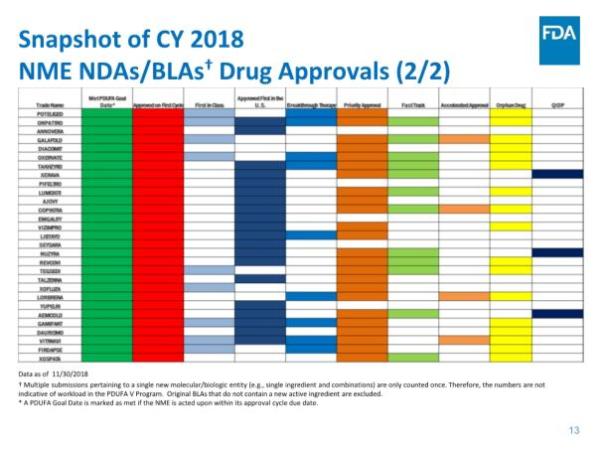
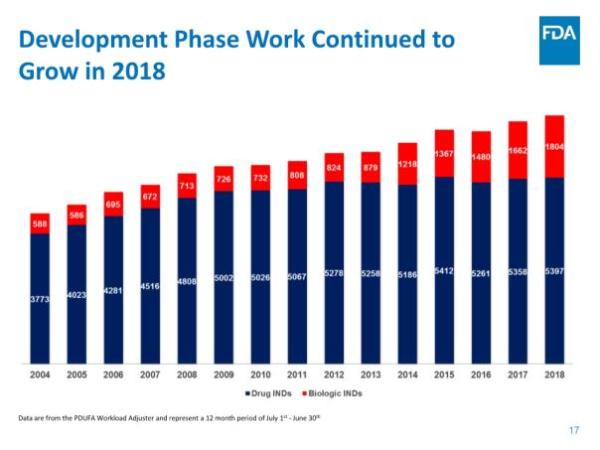
美国食品和药物管理局(FDA)药物评价和研究中心(CDER)近期发布了《2018年度新药评审报告》,对即将过去的这一年中的工作进行了总结。根据报告,截止2018年11月30日,CDER共批准了55个新分子实体(NME),其中41个新药申请(NDA),14个生物制品许可申请(BLA)。与以往NME主要集中在肿瘤学领域不同,今年是有史以来第一次大多数NME用于治疗罕见病,55个NME中就有31个是孤儿药。这直接反映了制药行业对孤儿药的开发热情正在急剧升温。而截至发稿时,今年第56款新药刚刚获得批准上市,是来自Shire公司治疗慢性特发性便秘(CIC)的5-HT4受体激动剂Motegrity(prucalopride),使得今天的NDA数量增加到42个。
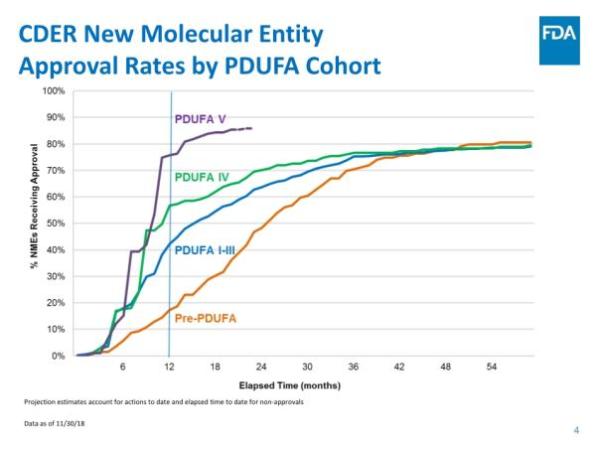
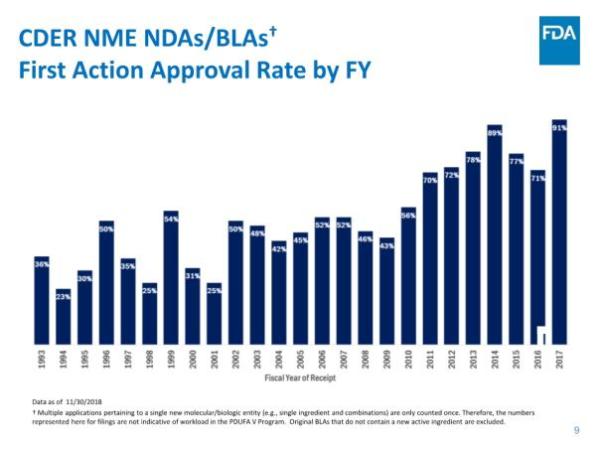
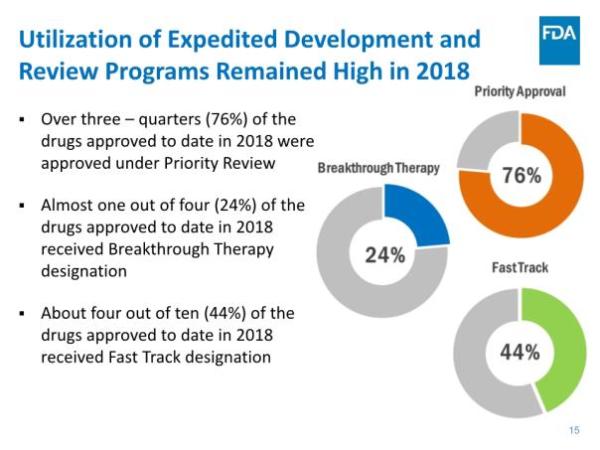
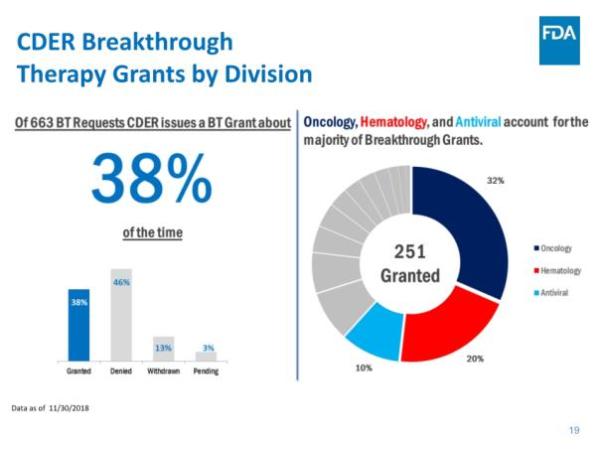
报告指出,CDER在NME审批方面继续保持高效率:统计中的55个新药全部在PDUFA目标日期完成批准,其中52个(占95%)是在第一个审查周期获得批准。这与FDA实施的4种加速审批程序密不可分,42个新药(占76%)通过优先审评批准,24个(占44%)被授予快速通道资格,13个(占比24%)被授予突破性药物资格,4个(占比7%)通过加速批准途径获批。
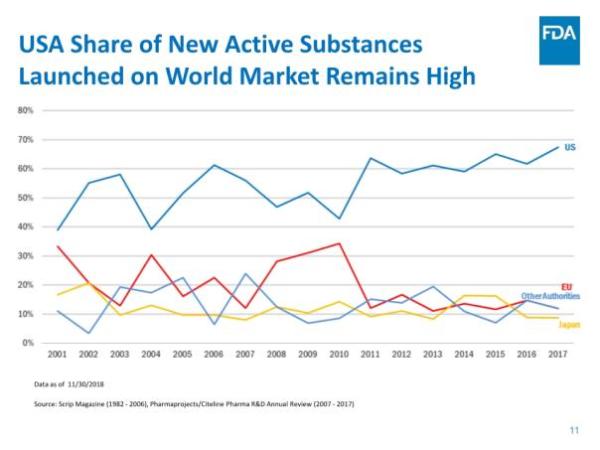
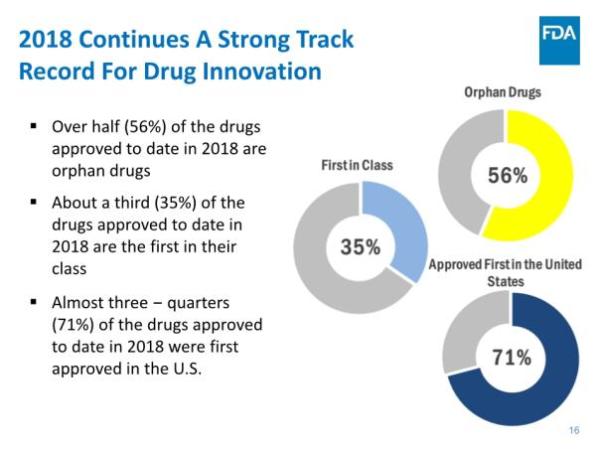
报告还指出,在药物创新方面,美国继续引领全球:55个新药中,有31个(占56%)是孤儿药,19个(35%)是首创类(first-in-class)药物,39个(占71%)率先在美国获得批准。
以下是报告的全文:







来源:新浪医药
版权及免责声明:本网站所有文章除标明原创外,均来自网络。登载本文的目的为传播行业信息,内容仅供参考,如有侵权请联系答魔删除。文章版权归原作者及原出处所有。本网拥有对此声明的最终解释权。


{replyUser1} 回复 {replyUser2}:{content}