追踪KRAS突变癌症研究最新进展
肿瘤发生和发展受癌基因驱动。在众多癌基因中,RAS基因家族在人类肿瘤中突变概率最高,被视为癌基因领域中的'珠穆朗玛峰'。RAS突变肿瘤占人类所有恶性肿瘤的三分之一,其中KRAS作为RAS基因家族中的主要亚型,促发人类多种致死性肿瘤,如肺癌、结肠癌和胰腺癌。然而,由于KRAS信号通路调控的复杂性以及KRAS突变肿瘤对临床药物的抵抗性,使得目前临床上仍无治疗KRAS突变肿瘤的有效药物和方法。
针对95%的发生KRAS突变的胰腺癌和高达30%的发生KRAS突变的非小细胞肺癌,当前尚无有效的治疗方法。一直以来,科研工作者都致力于找到药物能抑制KRAS本身或KRAS信号通路中的关键分子。
1.Cancer Discov:重大突破!Galectin-3抑制剂有望治疗对KRAS上瘾的癌症
doi:10.1158/2159-8290.CD-17-0539
 杀伤性T细胞包围着癌细胞,图片来自NIH。
杀伤性T细胞包围着癌细胞,图片来自NIH。
在一项新的研究中,来自美国加州大学圣地亚哥分校医学院的研究人员报道大约一半的起源自KRAS突变的肺癌和胰腺癌在疾病进展期间对这个基因上瘾。通过理解导致这些癌症继续依赖于KRAS才能存活的机制,他们能够鉴定出一种能够靶向它的药物。相关研究结果于2017年9月11日在线发表在Cancer Discovery期刊上,论文标题为“Galectin-3, a druggable vulnerability for KRAS-addicted cancers”。
针对95%的发生KRAS突变的胰腺癌和高达30%的发生KRAS突变的非小细胞肺癌,当前尚无有效的治疗方法。这些研究人员发现蛋白Galectin-3结合到细胞表面受体整合素avb3上,会增强KRAS突变体带来的优势,从而产生一种独特的弱点,让现有的药物去靶向。
Cheresh团队发现一种被称作GCS-100的Galectin-3抑制剂在体外能够杀死对KRAS上瘾的癌细胞,并且在模式小鼠体内能够阻止对KRAS上瘾的肿瘤进展。重要的是,他们发现仅当肿瘤表达整合素αvb3时,它才对这种药物作出反应。
2.Nature:重大突破!利用靶向KRAS突变基因的外泌体治疗胰腺癌
doi:10.1038/nature22341
 外泌体(exosome)是所有细胞释放出的病毒大小的颗粒。它们天然地存在于血液中。根据来自美国德州大学MD安德森癌症中心的一项新的研究,对外泌体进行基因操纵可能提供一种新的胰腺癌治疗方法。相关研究结果于2017年6月7日在线发表在Nature期刊上,论文标题为“Exosomes facilitate therapeutic targeting of oncogenic KRAS in pancreatic cancer”。论文通信作者为德州大学MD安德森癌症中心癌症生物学系研究员Raghu Kalluri博士。
外泌体(exosome)是所有细胞释放出的病毒大小的颗粒。它们天然地存在于血液中。根据来自美国德州大学MD安德森癌症中心的一项新的研究,对外泌体进行基因操纵可能提供一种新的胰腺癌治疗方法。相关研究结果于2017年6月7日在线发表在Nature期刊上,论文标题为“Exosomes facilitate therapeutic targeting of oncogenic KRAS in pancreatic cancer”。论文通信作者为德州大学MD安德森癌症中心癌症生物学系研究员Raghu Kalluri博士。
在这项新的研究中,经过基因修饰的外泌体(被称作iExosome)能够运送特异性地靶向KRAS突变基因的小RNA分子,从而导致胰腺癌模式小鼠病情缓解,增加它们的总存活率。这些研究人员采用了一种被称作RNA干扰(RNAi)的靶向方法:利用这些天然的纳米颗粒(即外泌体)运送小干扰RNA(siRNA)或短发夹RNA(shRNA)分子来靶向胰腺癌细胞中的KRAS突变基因,从而影响多种胰腺癌模型的肿瘤负荷和存活。他们证实外泌体能够作为一种高效的RNAi载体发挥作用,这是因为这些纳米大小的囊泡(即外泌体)轻松地在体内迁移和进入靶细胞(包括癌细胞)中。
作为一种分子通断开关的KRAS发生突变时会处于“开启”状态。在80%~95%的胰腺导管腺癌(PDAC)当中,这个基因发生突变,这也是这种癌症中最为常见的突变。这些研究人员证实iExosome能够运送特异性地靶向KRAS的siRNA和shRNA分子,并且比他们的合成对应物脂质体(liposome)更加高效。脂质体不具有外泌体表现出的天然复杂性和优势。
德州大学MD安德森癌症中心癌症生物学助理教授Valerie LeBleu博士说,“我们的研究提示着与脂质体相比,外泌体表现出运送siRNA分子和抑制侵袭性胰腺瘤生长的优异能力。我们也证实外泌体表面上的CD47存在允许它们躲避来自循环单核细胞的吞噬作用。”
这些研究人员也证实一种被称作巨胞饮(macropinocytosis)的细胞过程促进发生KRAS基因突变的癌细胞摄取外泌体。巨胞饮参与细胞清除营养物和囊泡。
Kamerkar说,“与之前的发现相一致的,由于增加的巨胞饮过程,达到胰腺的外泌体数量增加可能为外泌体进入KRAS相关的癌细胞提供进一步的优势。尽管胰腺瘤存在致密的基质,我们的结果也支持癌细胞高效地摄取iExosome。还需开展进一步的研究以便更好地理解通过巨胞饮进入细胞中的外泌体是否具有其他的可能增强它们的抗肿瘤能力的特征。”
3.Nat Commun:新研究发现一个治疗KRAS突变肿瘤的潜在靶点
doi:10.1038/ncomms14294
西班牙纳瓦拉大学的研究人员发现一个重要基因FOSL1会参与肺癌和胰腺癌的发育。这项工作还有美国、英国、德国和丹麦等国家的研究人员参与,最近发表在国际学术期刊Natue Communications上。
在这项研究中,研究人员利用一种生物信息学方法分析了不同癌症类型的病人样本,发现了8个受KRAS癌基因调控的基因。他们从这8个基因中选择了FOSL1进行重点研究,因为他们发现在肺癌和胰腺癌病人中,该基因发生突变的病人其生存情况最差,最重要的是抑制FOSL1可以导致肺部和胰腺肿瘤的尺寸大大减小。因此这些结果表明该基因有望成为新的治疗靶点。
研究人员还发现FOSL1会影响另外一个基因AUKRA,之前认为该基因的调控不依赖KRAS癌基因。他们还在研究中检测了联合使用AURKA靶向药物和MEK靶向药物的作用效果,结果发现这种组合可以有效清除肿瘤细胞。“事实上这种联合策略可以促进KRAS突变肿瘤的萎缩,这两种药物目前都已经应用于临床,对于病人来说这是一个非常好的消息,意味着他们或许可以在相对较短的时间内用上这种新的治疗策略。”文章作者Dr. Vicent这样表示。
4.Cell:揭示KRAS突变促进癌细胞抵抗治疗机制
doi:10.1016/j.cell.2016.11.035
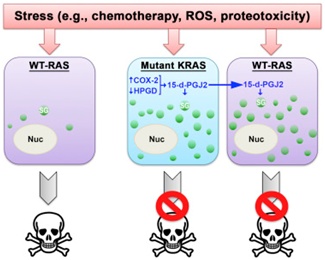 根据一项新的研究,促进一种致命性癌细胞侵袭性生长的信号同样也触发让它很难杀死的应对机制。当遭受应激时,这种癌细胞将它的遗传信息包裹在应激颗粒中,从而降低化疗效果。相关研究结果发表在2016年12月15日那期Cell期刊上,论文标题为“Mutant KRAS Enhances Tumor Cell Fitness by Upregulating Stress Granules”。
根据一项新的研究,促进一种致命性癌细胞侵袭性生长的信号同样也触发让它很难杀死的应对机制。当遭受应激时,这种癌细胞将它的遗传信息包裹在应激颗粒中,从而降低化疗效果。相关研究结果发表在2016年12月15日那期Cell期刊上,论文标题为“Mutant KRAS Enhances Tumor Cell Fitness by Upregulating Stress Granules”。
在来自美国纽约大学朗格尼医学中心和托马斯杰斐逊大学的两名研究人员的领导下,这项研究以基因KRAS为中心,当这个基因发生变化或突变时,它会触发90%的胰腺癌、很多肺癌和结直肠癌中的异常生长。研究人员说,作为过度活跃的KRAS的第二个后果,携带这种突变的细胞形成更多的应激颗粒。
在实验中,研究人员证实当遭受化疗或奥沙利铂---一种破坏癌细胞DNA的化疗药物---治疗时,携带KRAS突变的细胞制造的应激颗粒数量比不携带这种突变的细胞多6倍。他们也能够捕获从人胰腺瘤切除的癌细胞中的应激颗粒的首批图片,并且对这些应激颗粒进行计数,结果发现显著增加。
这项研究进一步发现在遭受应激下,携带KRAS突变的癌细胞通过更多地产生一种被称作15-脱氧-Δ12,14-前列腺素J2(15-deoxy-delta 12,14 prostaglandin J2, 15-d-PGJ2)的激素样分子而增加应激颗粒的形成。重要地,15-d-PGJ2水平增加会触发更多的应激颗粒形成,而且不仅是在发生KRAS突变的细胞中,而且也是在未发生这种突变的周围细胞中(增加13倍),随后这些细胞对奥沙利铂产生更强的抵抗性。这是因为15-d-PGJ2是细胞分泌出的一种信号分子。
5.Cell Rep:科学家找到靶向KRAS途径治疗肺癌的新靶点
doi:10.1016/j.celrep.2016.07.009
美国西南医学中心的研究人员最近发现了一条通过靶向KRAS基因治疗肺癌的新途径。KRAS基因是人类癌症中最常见的突变基因之一,也是很难成功进行靶向治疗的一个基因。
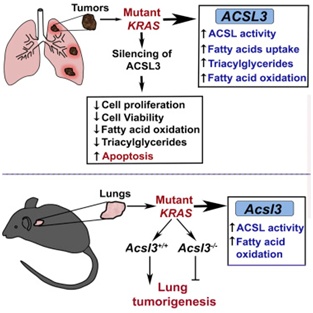
在该研究中研究人员对肺癌中的KRAS进行了研究,发现ACSL3介导的KRAS活性对于肺癌细胞存活至关重要,抑制ACSL3就会引起肺癌细胞死亡。
研究人员发现ACSL3的酶活性是突变的KRAS基因促进肺癌形成所需要的一个重要条件,进一步研究表明ACSL3的催化底物——脂肪酸在肺癌中扮演重要角色。
6.Nature子刊:邦耀生物团队发现有效治疗KRAS突变肿瘤的新策略
doi:10.1038/ncomms11363
2016年5月19日,华东师范大学生命科学学院院长、邦耀生物首席科学家、上海市调控生物学重点实验室主任刘明耀教授及团队成员逄秀凤副研究员的课题组在国际知名学术期刊Nature子刊《自然通讯》(Nature Communications,IF=11.329)上发表了题为'Suppression of KRas-mutant cancer through the combined inhibition of KRAS with PLK1 and ROCK'的文章,该研究成果揭示了KRAS突变肿瘤的分子特性以及有效治疗KRAS突变肿瘤的临床新策略。
针对KRAS突变肿瘤的危害性和临床治疗迫切性,近年刘明耀教授的研究团队和邦耀生物实验室共同建立了基于小分子化合物的'协同致死化学筛选'体系,开展规模性小分子化合物、临床药物及药物组合筛选。研究发现,联合临床PLK1激酶抑制剂和ROCK激酶抑制剂可特异性激活KRAS突变细胞中p21的抑癌功能,促发有丝分裂压力,从而有效并特异性地抑制KRAS突变细胞生长。本研究系统证实了KRAS突变肿瘤对有丝分裂压力的敏感性,首次揭示了KRAS基因与CDKN1A基因(编码p21蛋白)二者之间的依赖性关系,研究成果为KRAS突变肿瘤的治疗提供了新的靶向及有效的临床治疗策略。
7.Cell Rep:KRAS可以被“沉默”
doi:10.1016/j.celrep.2016.01.034
 最近在Cell Reports上发表的一篇文章,作者Sunita Shankar等人认为KRAS可能还存在其它我们未知的促进肿瘤发生、发展的功能。通过对KRAS和其它蛋白的相互作用的研究,以及探索其具体功能研究,将帮助我们找到新的药物靶点,作为癌症药物治疗上的新突破口。
最近在Cell Reports上发表的一篇文章,作者Sunita Shankar等人认为KRAS可能还存在其它我们未知的促进肿瘤发生、发展的功能。通过对KRAS和其它蛋白的相互作用的研究,以及探索其具体功能研究,将帮助我们找到新的药物靶点,作为癌症药物治疗上的新突破口。
科研人员首先通过免疫共沉淀技术和质谱分析方法,筛选了细胞内与RAS相互作用的蛋白。其中,他们发现了一个非常有趣的蛋白,叫Argonaute 2(AGO2)。这个蛋白在RNA介导的基因沉默中起着重要的作用。
然后,他们发现RAS和AGO2在内质网膜上共定位(相互作用)。AGO2通过其N端结构域与RAS相互结合,并且它们之间的结合会影响各自的生物学功能活性。另外,他们还发现KRAS的Y65氨基酸对KRAS和AGO2的相互作用非常重要。接着,科研人员发现AGO2对突变KRAS依赖的癌细胞增殖是必要的。值得注意的是,在体外细胞实验中,他们发现了AGO2似乎促进了KRAS对细胞促癌转变。进一步实验发现,突变KRAS和AGO2相互作用会让突变KRAS的细胞表现出更强的促癌效果。
8.Nat Rev Cancer:给KRAS-G12C一个'刹车'
doi:10.1038/nrc.2016.13
在人类癌症中,KRAS突变非常普遍,占30%左右。在肺癌中20%的KRAS存在G12C突变,KRAS是首批被发现的致癌基因之一,但几十年来研究人员试图找到能靶向它的药物。因为这个酶在结构上缺乏让小分子或药物结合的靶点,一直以来在寻找专一靶向对这个小GTP酶的药物没有任何突破。所以KRAS被广泛认为是一个不能成药的蛋白。而最近关于靶向KRAS -G12C的抑制剂研究就有两篇文章分别在Cancer Discovery和Science上发表。其中前两篇文章通过实验发现并证明了一种只特异性针对KRAS -G12C突变体功能的抑制剂(ARS-853)。
Cancer Discovery文章设计出一个新型强效抑制剂ARS-853,特异靶向KRAS-G12C的结合口袋与交换口袋,从而抑制住KRAS-G12C的生物活性,抑制住其促肿瘤的能力。通过质谱分析手段检测了KRAS-G12C的生物活性,接下来通过高分辨率晶体结构分析了ARS-853与KRAS-G12C的结合能力。
接下来,这篇Cancer Discovery和Science文章都发现在多个KRAS-G12C表达的肺癌细胞内,使用ARS-853能显著降低GTP结合的KRAS水平,还降低了KRAS的磷酸化水平以及抑制KRAS与下游信号分子的相互作用。这两项研究都证明了ARS-853诱导癌细胞凋亡,Cancer Discovery还报道了2D和3D培养下抑制肿瘤细胞生长。另外,这两篇文章都发现ARS-853能抑制肿瘤细胞增殖,并通过外源表达KRAS -G12C能恢复细胞生长于与增殖,进一步证明了ARS-853对KRAS-G12C的特异性。
9.EMBO Mol Med:KRAS基因突变点亮或可筛查子宫内膜异位症
doi:10.1002/emmm.201100200
耶鲁大学医学院的研究人员第一次描述了影响数百万被慢性骨盆痛和不育症所标志的妇女的子宫内膜异位症遗传基础。研究人员的这个新基因突变发现为新筛查方法提供了希望。
发表在2月3日版的在线刊EMBO Molecular Medicine的研究探讨了位于KRAS基因上的遗传性突变,该突变导致异常子宫内膜生长和子宫内膜风险。在子宫内膜异位症中,子宫组织生长在机体其他部分,如腹腔、卵巢、阴道和子宫颈。这种情况通常是遗传性的,在5-15%的育龄妇女中发现,影响着全世界多于7000万妇女。
在通讯作者Hugh S. Taylor博士、产科妇科和生殖科学系的生殖内分泌学与不育症分部的教授与主管的领导下,作者们研究了132名子宫内膜异位症患者,评估了他们在负责调控的KRAS基因区域内的新鉴定突变。以前,这种突变与增加的肺癌及卵巢癌风险性相关,这是此研究的合著者、放射治疗学副教授Joanne Weidhaas博士所报道的。
我们发现,这项研究中31%的子宫内膜异位症患者携带这个突变,相当于总人口的5.8%', Taylor说,'这种突变的存在也与较高的KRAS蛋白水平和这些细胞增加的扩散能力相关。它也可解释子宫内膜异位症妇女的卵巢癌高风险性。'
10.JCI:Kras基因与胰腺癌生长有关
doi:10.1172/JCI59227
 在几乎所有胰腺癌中发现的一个突变蛋白不但在癌症的形成中而且在癌症持续的生长中发挥着重要的作用,根据密歇根大学综合癌症中心研究人员的一项新研究。这一发现为开发新的疗法治疗这种致命性疾病提供了可能的靶标。
在几乎所有胰腺癌中发现的一个突变蛋白不但在癌症的形成中而且在癌症持续的生长中发挥着重要的作用,根据密歇根大学综合癌症中心研究人员的一项新研究。这一发现为开发新的疗法治疗这种致命性疾病提供了可能的靶标。
研究人员已经知道,Kras基因中的突变导致了胰腺癌的形成。这些突变在常见的癌前病变中也经常看到,意味着它在胰腺癌中发挥了早期作用。
这项新研究,发表于2月份的Journal of Clinical Investigation上。研究发现,在小鼠中突变的Kras也能保持肿瘤的生长及帮助癌前肿瘤转变成浸润性肿瘤。当研究人员关闭Kras后,肿瘤消失了并且没有复发的迹象。
研究人员能够在设计的小鼠模型中操纵Kras基因,在癌症发展的各个时间点对Kras进行研究。在癌前病变中,关闭Kras消除了小鼠中的肿瘤,胰腺组织恢复正常,没有复发的迹象。在浸润性癌中,失活Kras杀死了癌细胞,但在胰腺中留下了类似纤维的疤痕,肿瘤没有复发。
11.Cell:重大突破!首次鉴定出抑制RAS癌基因的小分子
doi:10.1016/j.cell.2016.03.045
RAS基因在30%以上的人类癌症中发生突变,而且代表着药物开发者最为广受欢迎的癌症靶标之一。然而,由于RAS突变蛋白缺乏药物结合的口袋,这一目标一直难以实现。在一项新的研究中,来自美国西奈山伊坎医学院、斯克利普癌症斯研究所、阿尔伯特-爱因斯坦医学院和纽约结构生物学中心的研究人员鉴定出一种靶向这种重要的癌基因的新机制。相关研究结果发表在2016年4月21日那期Cell期刊上。论文通信作者是西奈山伊坎医学院肿瘤学教授E. Premkumar Reddy博士。
在这项研究中,研究人员鉴定出首个小分子能够同时抑制RAS癌基因激活的不同信号通路。这个被称作rigosertib或ON01910.Na的小分子作为一种蛋白-蛋白相互作用抑制剂发挥作用,阻止RAS与将正常细胞变成癌细胞的信号蛋白(包括RAF和PI3K等)相结合。研究人员开展结构学实验,证实了rigosertib的这个作用机制,并且证实这种靶向作用机制有潜力用于治疗几种由RAS癌基因驱动的癌症。
Reddy博士说,“这一发现是癌症领域的一个重大突破。rigosertib的作用机制代表着一种攻击无药可靶向的RAS癌基因的新策略。我们当前的重点是使用来自我们利用rigosertib开展的研究中提供的信息,设计下一代小分子RAS靶向疗法,而且激动人心的是,我们最近鉴定出我们认为可改善rigosertib性质的几种化合物。”


{replyUser1} 回复 {replyUser2}:{content}