盘点2018全球新上市的39个生物药

作者:玄药
21世纪是生命科学的世纪,当前美国科学院有超过半数的院士是从事生命科学领域的研究;美国联邦政府用于资助科学研究的预算中,其中有一半以上用于生命科学的研究。所以相对化学药来说,生物药在人类疾病的治疗领域发展越来越快。
生物技术药简称生物药,主要分为重组蛋白质药物、重组多肽药物、重组DNA药以及干细胞治疗药等。据测算2022年全球生物药市场将达3260亿美元。同时Frost&Sullivan预测中国生物药市场2021年也将达3269亿元规模。回顾2018年全球上市了93个新药。其中化学药54个,生物药39个。
首先我们综合看一下这39个药物的靶点和研发信息:
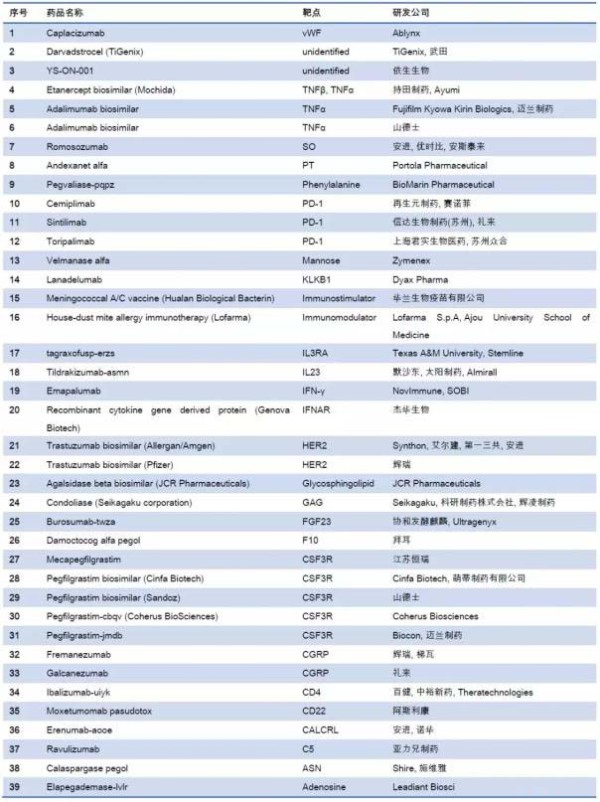
1. Caplacizumab
Ablynx研发的Caplacizumab于2018年8月31日获EMA批准上市,商品名为Cablivi®。是一种抗血管性血友病因子的纳米抗体,被批准用于治疗获得性血栓性血小板减少性紫癜(TTP)。
2. Darvadstrocel
Darvadstrocel 2018年3月23日被EMA批准上市,商品名为Alofisel®,是一种脂肪细胞异体替代疗法,含从脂肪中提取的人同种异体间质干细胞,该产品被批准用于治疗肛管直肠瘘。
3. YS-ON-001
YS-ON-001是由依生生物开发并上市,商品名为依维卡®,于2018年在柬埔寨获批上市销售,用于治疗乳腺癌、结直肠癌、肝癌、肺癌和胃癌等实体瘤
4. Etanercept biosimilar
持田制药研发的依那西普(Etanercept)生物类似药于2018年1月19日获PMDA批准上市,依那西普生物类似药是一种肿瘤坏死因子(TNF)阻断剂,能特异性结合于TNF分子,抑制TNF-α 和TNF-β与细胞表面TNF受体的结合。该药用于治疗类风湿性关节炎和幼年特发性关节炎。
5. Adalimumab biosimilar
Hulio®
FKB-327由富士协和麒麟生物公司研发,于2018年10月获EMA批准上市,商品名为Hulio®。是一种靶向于肿瘤坏死因子α的全人源IgG1型的阿达木单抗的生物类似药,被批准用于治疗类风湿性关节炎,强直性脊柱炎,银屑病关节炎,牛皮癣,化脓性汗腺炎,克罗恩病,溃疡性结肠炎,葡萄膜炎,幼年型类风湿性关节炎和斑块状银屑病。
6. Adalimumab biosimilar
Hefiya® 是阿达木单抗(Adalimumab)的生物类似药,于2018年7月26日获EMA批准上市,由山德士公司研发并负责上市,是一种肿瘤坏死因子α(TNFα)抑制剂,被批准用于治疗脊柱关节炎、葡萄膜炎、化脓性汗腺炎、银屑病、幼年特发性关节炎、银屑病关节炎、丘疹鳞状皮肤病、克罗恩氏病、溃疡性结肠炎和儿童斑块状银屑病。
7. Romosozumab
Romosozumab已于2018年1月获EMA批准上市,商品名为Evenity®
是一种靶向于硬化蛋白的单克隆抗体,批准用于治疗高骨折风险绝经妇女和高骨折风险男性的骨质疏松症。
8. Andexanet alfa
Portola制药开发的Andexanet alfa已于2018年5月3日获得FDA批准上市,商品名为Andexxa®。是一种重组修饰的凝血因子Xa,可结合凝血因子Xa抑制剂利伐沙班和阿哌沙班,从而发挥促凝血作用。该药批准用于用利伐沙班和阿哌沙班治疗的患者中发生危及生命或不可控的出血的逆转抗凝治疗。
9. Pegvaliase-pqpz
Pegvaliase-pqpz已于2018年5月24日获FDA批准上市,商品名为Palynziq®,是一种重组的苯丙氨酸代谢酶,由重组苯丙氨酸氨基裂解酶与N-羟基琥珀酰亚胺(NHS)-甲氧基聚乙二醇(PEG)偶联而成,能将苯丙氨酸转化为氨和反式肉桂酸。该产品用于降低苯丙酮尿症患者(血液苯丙氨酸浓度超过600 μmol/L)的血液苯丙氨酸浓度。
10. Cemiplimab
Cemiplimab于2018年9月28日获FDA批准上市,商品名为Libtayo®,是一种PD-1的单克隆抗体,被批准用于治疗转移性皮肤鳞状细胞癌(CSCC)或不能接受治愈性手术或放疗的局部晚期CSCC患者。
11. Sintilimab信迪利单抗
信迪利单抗(IBI-308)是信达生物开发的一种PD-1,用于至少经过二线系统化疗的复发或难治性经典型霍奇金淋巴瘤的治疗于2018年12月27日获NMPA批准上市,商品名为达伯舒®(Tyvyt®),此外,治疗晚期的或转移性鳞状非小细胞肺癌、胃及胃食管交界处腺癌的研究,现处于临床III期。
12. Toripalimab
特瑞普利单抗(JS001) 商品名为拓益®,2018年12月17日特瑞普利单抗注射液的上市申请获得NMPA批准成为首个在中国上市的中国自主研发的PD-1单抗。是上海君实生物医药科技股份有限公和苏州众合生物医药科技有限公司(君实生物子公司)开发的一种人源化单克隆抗体,靶向于程序性死亡受体1(PD-1),用于治疗既往接受全身系统治疗失败后的不可切除或转移性黑色素瘤患者,拟用于治疗乳腺癌、淋巴瘤、恶性黑色素瘤、泌尿生殖系统癌症和其它种类实体瘤,
13. Velmanase alfa
Zymenex(Chiesi Farmaceutici的子公司)研发的Velmanase alfa于2018年3月23日获EMA批准上市,商品名为Lamzede®,是一种重组α-甘露糖苷酶,可补充或替代天然α-甘露糖苷酶,以减少甘露糖的贮积。该药被批准用于治疗轻度至中度α甘露糖苷贮积症。
14. Lanadelumab
Lanadelumab于2018年8月23日获FDA批准上市,商品名为Takhzyro®,是一种靶向于血浆激肽释放酶(pKal)的人源性单克隆IgG1抗体,用于预防12岁及以上遗传性血管性水肿(HAE)患者的血管性水肿发作。
15. Meningococcal A/C vaccine
华兰生物疫苗研发的A群及C群脑膜炎球菌疫苗(Meningococcal A/C vaccine)于2018年3月20日获NMPA批准上市。A群及C群脑膜炎球菌疫苗被批准用于预防A群及C群脑膜炎球菌引起的流行性脑脊髓膜炎。
16. House-dust mite allergy immunotherapy
由Lofarma研发的屋尘螨过敏免疫疗法,于2018年批准上市,商品名为LAIS Mites Sublingual tablets®,是一种免疫疗法,被批准用于治疗过敏性哮喘、鼻炎和鼻结膜炎
17. tagraxofusp-erzs
Tagraxofusp-erzs于2018年12月获FDA批准上市,商品名为Elzonris®。此药是一种靶向CD123的细胞毒素,是由白介素-3和白喉毒素部分片段形成的重组融合蛋白。该药被批准用于治疗急性浆细胞样树突状细胞瘤(BPDCN)的成人及2岁以上的儿童患者。
18. Tildrakizumab-asmn
Tildrakizumab-asmn于2018年3月20日获FDA批准上市,后于2018年9月17日获EMA批准上市,Ilumya®,是一种人源化IgG1κ型单克隆抗体,靶向于白细胞介素23(IL-23)的p19亚基,能阻断p19亚基与白细胞介素23(IL-23)受体的相互作用。该药被批准用于治疗成人中至重度斑块状银屑病。
19. Emapalumab
Emapalumab单抗已经于2018年11月20日获得FDA的上市批准。该药由Novimmune SA研发、销售,商品名为Gamifant®,是一种靶向干扰素-γ(IFN-γ)的全人源单抗,批准用于治疗原发性嗜血细胞性淋巴组织细胞增多症(HLH)的成人或婴幼儿患者。
20. Recombinant cytokine gene derived protein
此品由杰华生物开发,已于2018年4月12日获得NMPA批准上市,商品名乐复能®,是一种重组细胞因子基因衍生蛋白,其结构与序列天然的干扰素有很大不同,可抑制病毒复制,增强抗病毒免疫,同时也可增强自身免疫力并抑制肿瘤细胞增殖、肿瘤血管生长,以阻断肿瘤血液供应,用于治疗慢性乙型肝炎。
21. Trastuzumab biosimilar
Kanjinti®已于2018年5月16日获EMA批准上市,于2018年9月21日获PMDA批准上市。该产品是曲妥珠单抗(Trastuzumab)的生物类似药,即一种靶向于HER2的人源化IgG1单克隆抗体,用于治疗HER2+早期乳腺癌和胃癌。
22. Trastuzumab biosimilar
Trazimera®是曲妥珠单抗的生物类似物,由Pfizer公司研发,于2018年7月26日获EMA批准上市,是一种人源化IgG1型单克隆抗体,其与肿瘤细胞上的HER2结合并介导抗体依赖的细胞毒作用(ADCC)。该药用于治疗HER2过表达的乳腺癌患、HER2过表达的转移性胃癌或食管胃交界腺癌。
23. Agalsidase beta biosimilar
JCR Pharmaceuticals开发的阿加糖酶β生物仿制药于2018年9月21获PMDA批准上市。阿加糖酶β是一种重组半乳糖苷酶α,被批准用于治疗法布里病。
24. Condoliase
Condoliase由生化学工业株式会社研发,于2018年3月获PMDA批准上市,商品名为Hernicore®。是一种糖胺聚糖降解酶,可以诱导椎间盘组织的软骨素-6硫酸蛋白聚糖溶解。该产品被批准用于治疗椎间盘移位。
25. Burosumab-twza
由Kyowa Hakko Kirin原研的Burosumab-twza已于2018年2月19日获EMA批准,2018年4月17日获FDA批准上市,商品名为Crysvita®,是一种全人源IgG1型单克隆抗体,靶向于成纤维细胞生长因子23(FGF23),批准用于治疗X连锁低磷酸盐血症(XLH)。这是首个获批治疗1岁及以上儿童和成年人的X连锁低磷血症(XLH)的孤儿药。
26. Damoctocog alfa pegol
Jivi®(Damoctocog alfa pegol)是Bayer研发的一种聚二乙醇化的重组人凝血因子VIII,于2018年8月29日获FDA批准上市。Jivi®是一种重组因子VIII(rFVIII)替代疗法,可替代凝血过程中缺失的凝血因子VIII。Jivi®获批适用于先前治疗的成人和青少年(12岁及以上)的血友病A患者,用于按需治疗和控制出血事件;围手术期出血;常规预防以减少出血发作的频率。
27. Mecapegfilgrastim
江苏恒瑞开发的硫培非格司亭已于2018年5月8日获得NMPA批准上市,商品名为艾多®。该产品是一种聚乙二醇化重组粒细胞集落刺激因子,用于化疗引起的中性粒细胞减少症。
28. Pegfilgrastim biosimilar (Cinfa Biotech)
培非格司亭生物仿制药(Cinfa Biotech)于2018年11月20日通过EMA批准上市,商品名为Pelmeg®,是一种皮下注射的溶液,活性成分为聚乙二醇化重组粒细胞集落刺激因子,用于治疗化疗引起的中性粒细胞减少症,并可预防发热性中性粒细胞减少症。
29. Pegfilgrastim biosimilar
Zioxtenzo®是诺华的子公司山德士研发的pegfilgrastim生物类似药。此药于2018年12月在英国获批上市,是一种聚乙二醇化的重组人粒细胞集落刺激因子,能调节骨髓中性粒细胞的产生,并影响中性粒细胞前体的增殖、分化和功能。该药用于治疗非髓性恶性肿瘤患者发热性中性粒细胞减少症。
30. Pegfilgrastim-cbqv
Pegfilgrastim-cbqv由Coherus Biosciences研发,于2018年11月2日获FDA批准上市,后于2018年9月21日获EMA批准上市,商品名为Udenyca®,是一种聚乙二醇化重组粒细胞集落刺激因子,用于治疗化疗引起的中性粒细胞减少症。
31. Pegfilgrastim-jmdb
Pegfilgrastim-jmdb已于2018年6月4日获FDA批准上市,商品名为Fulphila®。
Pegfilgrastim-jmdb是Pegfilgrastim的生物类似药,即一种重组甲硫氨酰人粒细胞集落刺激因子(G-CSF)和单甲氧基聚乙二醇的共价缀合物。该产品用于治疗骨髓抑制性抗癌药引起的发热性中性粒细胞减少症。
32. Fremanezumab
Fremanezumab于2018年9月14日获FDA批准上市, 商品名为Ajovy®,是一种靶向于降钙素基因相关肽(CGRP)的人源化IgG2κ型单克隆抗体,被批准用于治疗成人偏头痛。
33. Galcanezumab
Galcanezumab由Lili公司研发,于2018年9月27日获FDA批准上市,商品名为Emgality®,是一种人源化单克隆抗体,靶向于降钙素基因相关肽(CGRP),被批准用于治疗成人患者偏头痛。
34. Ibalizumab-uiyk
Ibalizumab-uiyk 2018年3月6日首次被FDA批准上市,商品名为Trogarzo®,是一种人源化IgG4型单克隆抗体,其通过结合CD4的结构域2,干扰HIV-1侵入宿主细胞的过程,来阻止HIV-1感染CD4+T细胞。该药批准的适应症为成人HIV-1病毒感染,包括曾接受多种抗HIV-1方案,对其它抗逆转录病毒 药物有抗药性和目前抗逆转录病毒疗法失败的患者。
35. Moxetumomab pasudotox
Moxetumomab pasudotox由AZ公司研发,于2018年9月13日获FDA批准上市,商品名为Lumoxiti®,是一种重组的靶向于CD22的抗毒素,被批准用于治疗毛细胞白血病的。
36. Erenumab-aooe
Erenumab-aooe已于2018年5月17日获FDA批准上市,商品名为Aimovig®,是一种全人源IgG2型单克隆抗体,靶向于降钙素基因相关肽(CGRP)受体。该药批准用于预防和治疗成人偏头痛。
37. Ravulizumab
由Alexion Pharma研发的Ravulizumab于2018年12月21日获FDA批准上市,商品名为 Ultomiris®,是一种靶向于补体蛋白C5的人源化单克隆抗体,治疗阵发性睡眠性血红蛋白尿的孤儿药。
38. Calaspargase pegol
Calaspargase pegol于2018年12月获FDA批准上市,商品名为Asparlas®。该药是一种天冬酰胺特异性酶,可以催化L-天冬酰胺为天冬氨酸和氨,批准用于针对小儿和成人淋巴系白血病的多药物化疗的辅助药物。 Asparlas®的药理作用是基于清除血浆中的L-天冬酰胺,进而杀伤白血病细胞。
39. Elapegademase-lvlr
Elapegademase-lvlr由Leadiant Biosci研发,于2018年10月5日获FDA批准上市,商品名为Revcovi®,是一种重组腺苷脱氨酶,用于治疗儿童和成人免疫缺陷病患者的ADA缺乏症(ADA-SCID)。
生物药的发展在整个医药行业呈现快速上升趋势,越来越多的公司积极投入到生物药的研究中。但同时中国的生物物创新相比于欧美国家还较为落后,国内生物药市场绝大部分份额还被外资企业产品占据和主导。据IMS Health预计,到2020年,我国生物医药市场将成为仅次于美国的全球第二大生物医药市场。
来源:新浪医药
版权及免责声明:本网站所有文章除标明原创外,均来自网络。登载本文的目的为传播行业信息,内容仅供参考,如有侵权请联系答魔删除。文章版权归原作者及原出处所有。本网拥有对此声明的最终解释权。


{replyUser1} 回复 {replyUser2}:{content}