抗精神分裂症新药鲁拉西酮即将造福国内患者

治疗需求尚未满足
精神分裂症是一种严重的精神障碍,据世界卫生组织统计,全球有超过 2100 万人正在遭受精神分裂症的困扰,这种疾病还是15至44岁年龄组人群的第八大致残原因。截至 2016 年底,我国登记在册的精神分裂症患者人数约为405万。
现有精神分裂症治疗药物大致可分为两大类:一类为典型抗精神病药,又称为第一代抗精神病药;另一类为非典型抗精神病药,普遍具有多巴胺D2/5-HT2A受体拮抗作用,又称为第二代抗精神病药。
2010年以来,国内样本医院的精神类药物市场规模从12.5亿元增长到2015年的24.7亿元,5年的复合年均增长率达14.6%。
鉴于精神分裂症发病机理尚未完全阐明、现有治疗药物疗效的局限及不良反应,临床需要疗效更好、不良反应更小的治疗药物。国内精神科医疗资源缺乏,精神药物市场潜力巨大。
国内首个上市申请
盐酸鲁拉西酮是日本住友制药公司开发的一种具有双重作用的非典型抗精神病药,对5-HT2A受体和多巴胺D2受体均具有高度亲和力。
基于一项为期6周的研究结果,FDA于2010年10月28日批准了盐酸鲁拉西酮片在美国的上市申请,商品名为Latuda,患者每日口服一次,用于精神分裂症的一线治疗。
在该研究中,青少年精神分裂症患者随机分成3组,每日服用安慰剂或鲁拉西酮40 mg、80 mg。与安慰剂组相比,盐酸鲁拉西酮组患者精神分裂症症状呈现具有统计学意义的临床改善。鲁拉西酮耐受性良好,临床主要不良反应为低血压和QT间期延长。
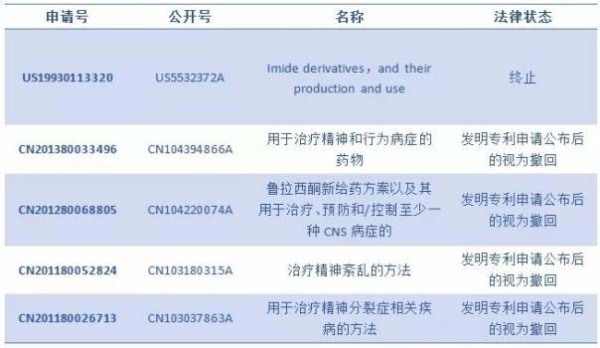
2013年,住友制药启动盐酸鲁拉西酮片国内的临床试验,2015年提交生产申报,属化药注册分类3.1类。目前,国内尚无医药企业获准进口或生产盐酸鲁拉西酮或其制剂。
住友制药盐酸鲁拉西酮在美国的专利US5532372于2013年到期,在国内的专利有4项,均处于"发明专利申请公布后的视为撤回"的法律状态。
国内本土制药企业布局情况
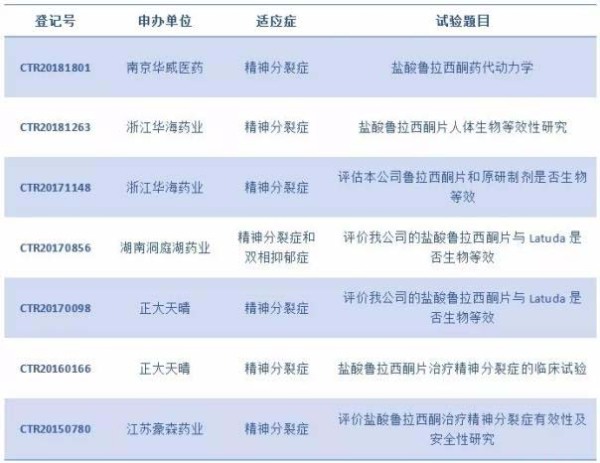
截至目前,国内已经有多家本土制药企业布局了盐酸鲁拉西酮片的仿制药,其中包括南京华威医药、浙江华海药业、湖南洞庭湖药业、正大天晴、江苏豪森药业进入了临床试验阶段。
来源:生物探索
版权及免责声明:本网站所有文章除标明原创外,均来自网络。登载本文的目的为传播行业信息,内容仅供参考,如有侵权请联系答魔删除。文章版权归原作者及原出处所有。本网拥有对此声明的最终解释权。


{replyUser1} 回复 {replyUser2}:{content}