把癌细胞变成脂肪细胞,可能吗?
今天,《细胞》出版社旗下的《Cancer Cell》杂志发表了一篇极为吸引眼球的论文。来自瑞士的一支科研团队发现,一种抗癌药和一种糖尿病药物的组合,竟然能把乳腺癌细胞变成脂肪细胞,有效抑制癌症转移。

这项研究的关键,在于抓住了癌细胞“变身”的时间点。原来在癌症病情发展的过程中,存在一个叫做“上皮-间充质转化”(EMT)的阶段。这一阶段内,癌细胞具有类似于“干细胞”的特质,有潜力转化成多种细胞类型。利用EMT,这些癌细胞会从初始的肿瘤中脱离,向远处发生转移。
如果能通过药物调控癌细胞的信号通路,让他们变成无害的细胞,岂不是就能抑制癌细胞转移了吗?这群科学家们正是这么想的。而他们计划让癌细胞变成的,是许多爱美人士所排斥的脂肪细胞。
为什么选择脂肪细胞?一方面,脂肪细胞不会分裂,比较安全。另一方面,我们对于脂肪形成的通路有着较好的理解,也有一些现成的方法可以促进脂肪细胞的转化。当然,要让癌细胞变成脂肪细胞,我们还需要做一定的优化。这正是这群科学家们在研究里首先做的尝试。优化结果表明,从小鼠模型中分离出的乳腺癌细胞,在糖尿病药物rosiglitazone与一种叫做BMP2的蛋白的共同作用下,能高效变成脂肪细胞。
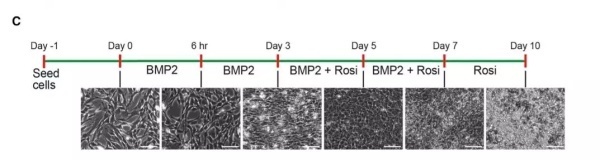
▲研究人员们摸索出了把癌细胞诱导成脂肪细胞的方法(图片来源:参考资料[1])
体外实验的成功,让科学家们得以进一步研究将癌细胞变为脂肪细胞的信号通路。RNA测序的结果找到了许多与这一转变有关的转录因子。其中,TGF-β信号通路有着关键的调节作用,进一步的分析则找到了MEK这个关键蛋白——在通常情况下,TGF-β信号通路会抑制脂肪细胞的转化。而倘若能抑制MEK的功能,就可以反过来促进形成脂肪细胞。
可喜的是,早在2013年,美国FDA就批准了一款MEK抑制剂上市,药物名是trametinib。它能促进癌细胞变成脂肪细胞吗?更关键的是,这种新颖的策略,在动物体内能取得成功吗?
为了回答这些问题,科学家们做了一个关键的实验。他们在小鼠体内引入了表达绿色荧光蛋白的人类乳腺癌细胞。先前的研究表明,这些癌细胞很容易会转移到肺部。随后,研究人员们给这些小鼠使用了安慰剂、rosiglitazone、trametinib、以及rosiglitazone +trametinib,评估四种不同治疗方案对于肿瘤生长和转移的抑制效果。
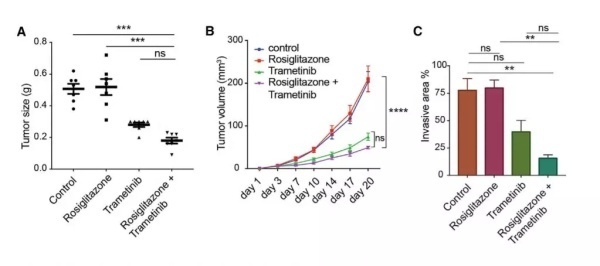
▲组合疗法在抑制肿瘤侵袭性方面,有着很好的效果(图片来源:参考资料[1])
研究表明,接受trametinib单独疗法或组合疗法治疗的小鼠,肿瘤体积都出现了明显缩小。这并不令人奇怪,毕竟trametinib本身就是个抗癌药。然而接受了组合疗法的小鼠,肿瘤的侵袭性出现了显著降低!病理切片结果也表明,相比对照组,组合疗法几乎“完全杜绝了转移的发生”。
染色结果证实,一些癌细胞成功被转化成了脂肪细胞。
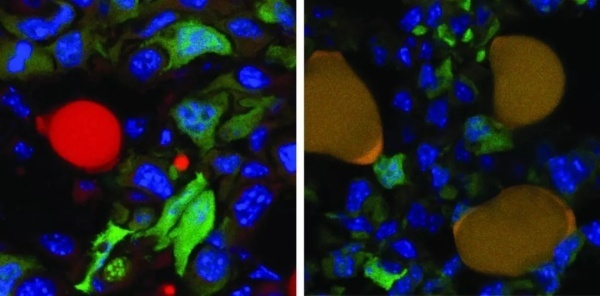
▲在组合疗法的作用下,绿色的癌细胞被转化成了红色的脂肪细胞(图片来源:Department of Biomedicine, University of Basel)
更为可喜的是,利用真实患者肿瘤生成的嫁接模型,这一疗法的长期效果也得到了验证。在组合疗法的作用下,癌细胞无法入侵周围的组织,也无法向远处发生转移。
“这些处于EMT阶段的乳腺癌细胞不仅能分化成脂肪细胞,还彻底停止了增殖,”本研究的通讯作者Gerhard Christofori教授说道:“从我们的长期组织培养结果来看,那些由癌细胞转化而来的脂肪细胞不会再变回癌细胞。”
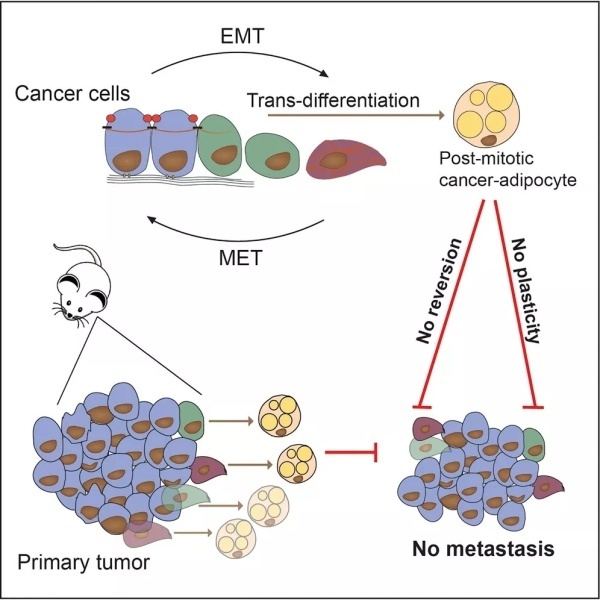
▲本研究的图示(图片来源:参考资料[1])
关于这一疗法,研究人员们猜测,它有望阻止肿瘤对常规化疗产生耐药性。接下来,他们希望能将这一组合疗法与化疗联用,进一步观察效果。此外,他们也期望在更多的癌症类型中测试这一方法。需要注意的是,这一疗法目前仅在小鼠实验中得到了验证。我们期待早日看到人类试验的积极结果。
参考资料:
[1] Dana Ishay-Ronen et a., (2019), Gain Fat—Lose Metastasis: Converting Invasive Breast Cancer Cells into Adipocytes Inhibits Cancer Metastasis, Cancer Cell, DOI: https://doi.org/10.1016/j.ccell.2018.12.002
[2] Conversion of breast cancer cells into fat cells impedes the formation of metastases, Retrieved January 14, 2019, from https://www.eurekalert.org/pub_releases/2019-01/uob-cob011019.php
来源:学术经纬
版权及免责声明:本网站所有文章除标明原创外,均来自网络。登载本文的目的为传播行业信息,内容仅供参考,如有侵权请联系答魔删除。文章版权归原作者及原出处所有。本网拥有对此声明的最终解释权。


{replyUser1} 回复 {replyUser2}:{content}