Humira诞生记:诺奖技术带来的重磅疗法
很多人说,新药研发的历史,就是我们了解生物学的历史。随着我们对基础生物学理解的不断加深,诸多创新生物医药技术也随之而来。近年来兴起的癌症免疫疗法、CAR-T疗法、基因疗法、以及RNAi疗法,就是最好的案例。
说到生物医药历史上的突破,就不得不提Humira(adalimumab,中文名修美乐)。自2002年首次获批上市以来,它先后获批治疗10多种不同的适应症,为全球广大患者带来了福音。此外,作为“噬菌体展示”技术带来的第一款药物,它在医药研发史上有着特殊的意义,也在2018年诺贝尔化学奖的官方通稿中得到了大篇幅的介绍。

这一切,还要从60多年前说起……
类风湿关节炎:希望与灾难的交织
2002年的最后一天,美国FDA批准Humira上市,治疗类风湿关节炎。这种疾病在全世界范围内有超过500万名患者。由于自身免疫系统的异常,患者的全身多处关节会出现炎症和进行性损伤,导致关节变形。由于疼痛,患者正常的日常活动都会出现困难。
在Humira问世前的相当长一段时间内,面对疾病对关节的侵蚀,很多风湿病专家都束手无策。在20世纪50年代,人们一度曾看到“终止”这种疾病的希望——可的松等类固醇激素在治疗这种疾病上,表现出了惊人的治疗效果。有史以来第一次,我们不仅能缓解患者的痛苦,还能阻止他们的疾病进展。

▲可的松的立体分子结构(图片来源:Ben Mills [Public domain], via Wikimedia Commons)
可以想象,患者们对这种“神药”趋之若鹜。在接下来的十年里,成千上万的患者接受了可的松治疗。谁也没有想到,这竟然是一场噩梦的开始。
很快,药物的副作用就呈现了出来。在患者中,医护人员们观察到了皮肤损伤、骨质疏松症、糖尿病、免疫防御机制受损等严重的症状。而停用可的松后,患者的疾病又会复发,导致关节持续损伤。糟糕的是,患者没有其他可用的治疗选择。
十余年后,这段不幸的历史得到了重现。一类名为非甾体抗炎药(NSAID)的药物横空出世,被用于患者的治疗。但很快,流产、早产、肾衰竭、以及胃肠道损伤等副作用开始出现。
希望与灾难的交织,很好地形容了早期对类风湿关节炎的治疗状况。
意外的发现
有意思的是,在对另一种自身免疫疾病的研究中,我们找到了治疗类风湿关节炎的全新靶点。让我们把时针拨回到上世纪80年代初。当时,澳大利亚的免疫学家Marc Feldmann教授正在研究一种会导致甲亢的疾病。在这种疾病里,一些甲状腺细胞会过度表达一类可以激活免疫反应的分子,而这种分子增多的背后,则是细胞因子的刺激。
基于这个观察结果,Feldmann教授提出了一个大胆的假设,激发自身免疫疾病的,或许正是细胞因子。

▲Marc Feldmann教授将细胞因子与免疫疾病联系到了一起(图片来源:参考资料[2])
为了验证这个想法,Feldmann教授决定从罹患自身免疫疾病的患者组织中,寻找是否含有过量的细胞因子。然而在他原本研究的疾病中,很难获取到足够量的炎症组织。于是,Feldmann教授决定从其他病变组织入手进行研究。当时,在类风湿关节炎的治疗中,医生经常会切除患病组织,以缓解患者的症状。这提供了足够的研究材料。
正如研究人员们所设想的那样,在类风湿关节炎患者的关节中,出现了大量促炎性的细胞因子。而且当细胞因子出现时,免疫调节机制是失控的。
顺着这个发现,研究人员们开始寻找可能治疗类风湿关节炎的方法。动物实验表明,IL-1是类风湿关节炎的潜在病因。那么,哪种细胞因子促发了IL-1的产生呢?
在患者关节中,有多种细胞因子在共同作用。当时,大多数人并不看好靶向单一细胞因子的治疗潜力。但Feldmann教授仍然决定一试究竟。
与另一位学者Ravinder Maini教授一道,Feldmann教授往培养基中加入了抑制各种细胞因子的抗体。和设想中一样,大部分的抗体都没有减少IL-1的产生。唯一的例外是作用于TNF-α的抗体。整整3天,它几乎完全抑制了IL-1的产生。
进一步的研究不但证实了TNF-α对IL-1产生的影响,还发现它可以抑制其他促炎症细胞因子的产生。一系列结果表明,仅仅阻断TNF-α,就可以明显缓解整个炎症反应。

▲导致类风湿关节炎的细胞因子级联反应(图片来源:参考资料[4])
研发的瓶颈
找到靶点,研发新药,推动上市,造福患者……在理想化的世界里,新药似乎就应该这么诞生。然而事实却多了些曲折。
在最初的动物模型中,一切看起来还算顺利。世界各地的研究都表明,向关节炎小鼠注射TNF-α抗体后,关节肿胀和损伤都大大改善。也就是说,这个潜在治疗靶点在动物研究里得到了验证。下一步,就是推进到患者体内了。
然而,来自小鼠的抗体并不适用于人体。即便这些抗体可以结合人类的TNF-α,但由于其基因序列来源于小鼠,这些抗体在人体内会引起免疫反应,有潜在的危险副作用。为此,我们需要一款人源化程度更高的抗体,通过基因改造,使其和人体自身的抗体更为相似,以免诱导免疫反应。
但新抗体的开发并非一日之功。在20世纪90年代早期,一些公司已经通过基因工程,开发出了人-鼠嵌合抗体。虽然这种嵌合抗体的非人源成分更少,但人体免疫系统仍然会产生“中和抗体”,影响治疗效果。为了治疗人类患者,我们需要进一步增加抗体的人源化比例。
全人源TNF-α抗体的诞生
幸运的是,生物学从未停下发展的步伐。随着基因工程的发展,人类抗体可变区编码基因的分离,以及“噬菌体展示”这两项技术的引入,让抗体人源化这一任务得以大大简化。
“噬菌体展示”正是在2018年斩获诺贝尔化学奖的技术,最早由George P. Smith教授在1985年开创。它的原理不难理解——首先,科学家在噬菌体的外壳蛋白基因序列中引入外源基因。随后,这些外源基因会与噬菌体外壳蛋白共同表达,并展示在噬菌体表面。
根据需求,研究人员可以在这些噬菌体表面上筛选出具有一定特性的蛋白质。随后,他们将编码这些蛋白质的相应基因再次引入噬菌体体内。如此反复“演化”,可以得到人们所需要的蛋白质。
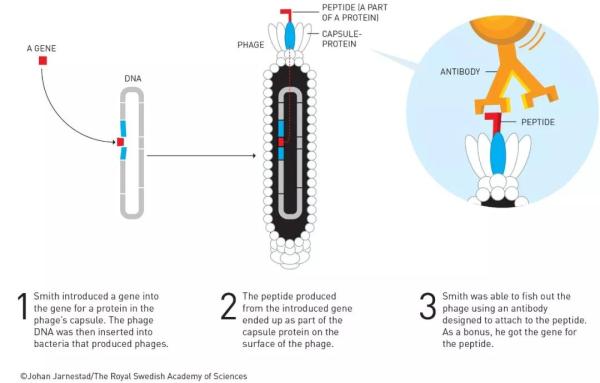
▲George P. Smith教授开创了“噬菌体展示”技术(图片来源:参考资料[6])
生化学家Gregory Winter教授从中看到了全新的机会。他敏锐地意识到,通过噬菌体展示进行抗体定向演化,将有机会开发出更好的抗体药物。
1989年,Winter教授的重要合作伙伴,Richard A. Lerner教授带来了一项技术,通过噬菌体展示,可以产生一个巨大的抗体组合库。这一重要成果发表于《科学》杂志,引来了大量关注,也为后来的抗体工程带来了巨大的帮助。
同年,Winter教授成立了剑桥抗体技术公司(CAT),致力于使用全新策略对TNF-α的动物抗体进行改造。在对噬菌体展示的多个过程进行多次优化后,研究人员们得到了一种完全人源化的抗体。这款被命名为D2E7的候选药物,和当时所有部分人源化的嵌合抗体都不一样!
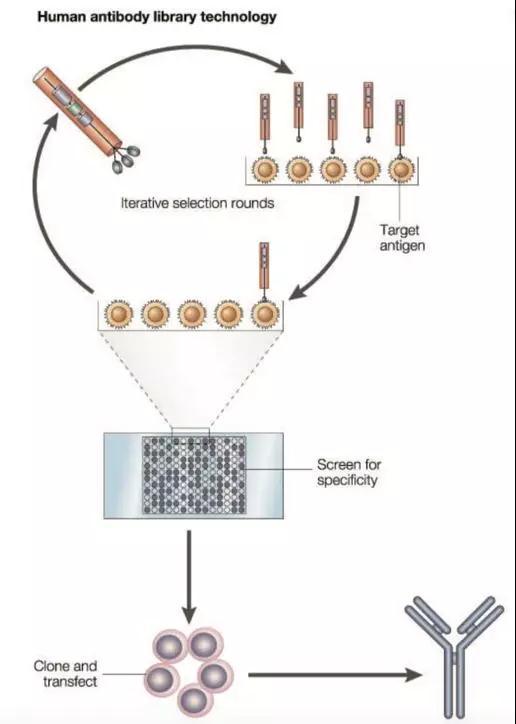
▲基于噬菌体展示的人源抗体技术(图片来源:参考资料[5])
这些科学家们为抗体工程所赋予的全新构想,使得人源化抗体的生产与应用成为可能。而这些抗体大放异彩的时刻,就要到来!
加速临床验证
得到人源化的抗体后,人们立刻展开了多项实验,来评估D2E7在类风湿关节炎治疗上的效果与安全性。首先,三种不同的体外细胞体系都表明,D2E7的确具有中和TNF-α的生物活性。在类风湿关节炎的小鼠模型中,对照组的小鼠出现了严重的关节炎,伴有软骨破坏和骨质侵蚀。而在D2E7的治疗下,实验组的小鼠,各种关节炎症状都消失了,且关节组织未出现病理学变化。
出色的临床前数据,让研究人员对这款抗体的潜力充满期待。随后,它也顺利进入了人体试验阶段。在首个人体试验中,D2E7表现出了非常令人鼓舞的治疗数据——在三个最高治疗剂量组中,40%-70%的患者达到了DAS和ACR 20缓解状态(美国风湿病学会疗效评估标准)。在安慰剂对照组中,这一比例只有19%。此外,这款疗法起效快速,给药24小时到一周内就能发挥功效,并在给药1-2周后达到最大疗效。临床数据同时也确认了D2E7的安全性。
在四项大型3期临床试验中,这款疗法的效果得到了确凿的证明。超过2000名类风湿关节炎患者的数据显示,在D2E7的作用下,治疗组比对照组显示出了更为显著的改善,部分患者甚至达到了3年以上的缓解。基于这些优秀治疗结果,D2E7在2002年的最后一天获美国FDA批准上市,治疗中度至重度活动性类风湿关节炎患者。这些患者之前对传统的疗法无反应,急需新型治疗方案。
这也是全球首个获批的全人源抗体。以修美乐(Humira)之名,它创下了一个又一个的新纪录。
造福更多疾病患者
获批上市,只是这款抗体造福患者的起点。随着在类风湿关节炎中的成功应用,科学家们也开始探索修美乐在其他具有相似炎症机制的慢性疾病中,具有怎样的疗效。
根据公开信息,目前修美乐在全球范围内,已有15个适应症获得批准,在全球超过100个国家和地区给患者带来新型的治疗方案。2010年,修美乐于中国上市,目前已获批治疗类风湿关节炎、强直性脊柱炎、以及中重度斑块状银屑病。
回溯历史,距离Feldmann教授第一次将细胞因子与免疫疾病联系到一起,已经过去了近40年。这些年里,众多科学家不断推动科学进展与临床转化,才让修美乐的诞生成为可能。自上市以来,这款重磅疗法迄今已治疗了超过100万名罹患免疫疾病的患者,也大大改善了类风湿关节炎患者的残疾率。这正是医学转化给人类带来的卓越贡献。
参考资料:
[1] The history of anti-rheumatic medicines is one of hope and disaster. Retrieved Oct 27, 2018,
[4] Bornadata Bain, et al., (2003). Adalimumab. Nature Reviews Drug Discovery
[8] Cambridge Antibody Technology: The History of the UK’s Best Biotech. Retrieved Oct 27, 2018
[9] Laurent S. Jespers, et al., (1994). Guiding the Selection of Human Antibodies from Phage Display Repertoires to a Single Epitope of an Antigen. Nature Biotechnology
[10] GREGORY WINTER AND RICHARD A. LERNER. Retrieved Oct 27, 2018
[11] William B. Coley Award. Retrieved Oct 27, 2018
[13] FDA Approves Adalimumab for Rheumatoid Arthritis. Retrieved Oct 27, 2018
来源:药明康德
版权及免责声明:本网站所有文章除标明原创外,均来自网络。登载本文的目的为传播行业信息,内容仅供参考,如有侵权请联系答魔删除。文章版权归原作者及原出处所有。本网拥有对此声明的最终解释权。


{replyUser1} 回复 {replyUser2}:{content}