华人学者连发5篇Nature!覆盖蛋白、细胞、RNA编辑等三大领域
最近,顶尖学术刊物的同一期杂志上经常出现华人学者的多篇文章。今年7月,《细胞》上就出现了6名华人学者同日发文的盛举;而在刚过去的9月,也有4篇来自于华人学者课题组的研究论文同日上线《自然》杂志。
今天,《自然》再次同日在线发表5篇来自华人学者的研究,延续了近几个月来的良好势头。
1、姜有星博士/白晓辰博士课题组
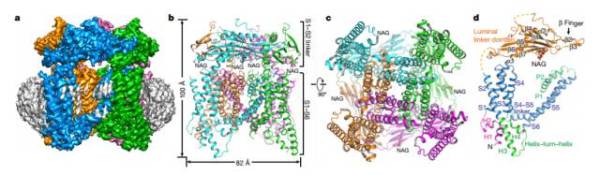
Structure of mammalian endolysosomal TRPML1 channel in nanodiscs
 姜有星博士
姜有星博士
 白晓晨博士
白晓晨博士
TRPML1是一种位于核内体与溶酶体膜上的阳离子通道,在哺乳动物细胞内普遍表达。如果它发生失活突变,就会导致严重的溶酶体贮积症。利用新鲜斩获诺贝尔化学奖的冷冻电镜技术,来自德克萨斯大学西南医学中心的姜有星教授课题组与白晓辰教授课题组联手获取了小鼠TRPML1通道位于nanodiscs中的结构。结构分析揭示,磷脂酰肌醇-3,5-二磷酸会结合该通道蛋白的N端,而S2与S3区域的螺旋-转角-螺旋区域可能会和配体发生偶联。此外,这个结构还发现了S4与S5区域链接部对于TRPML通道作用机制的潜在作用。
 2、李晓淳博士课题组
2、李晓淳博士课题组
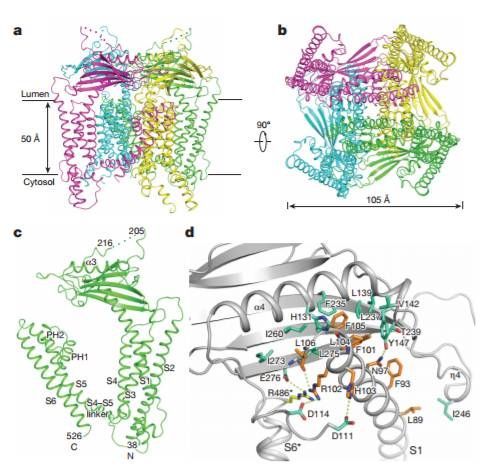
Human TRPML1 channel structures in open and closed conformations
 本期《自然》在线发表了两篇关于TRPML1的论文,第二篇同样来自德克萨斯大学西南医学中心,主要负责人之一是李晓淳教授。李教授博士后期间的导师,洛克菲勒大学的诺贝尔生理学或医学奖得主Günter Blobel教授也是通讯作者之一。在这项研究中,研究人员公布了全长的人类TRPML1蛋白冷冻电镜结构。值得一提的是,这支团队同时获得了该通道蛋白“关闭”和“开启”时的结构。研究人员指出,这些结构揭露了TRPML通道蛋白的调控机理,有望带来治疗由TRPML1突变引起的溶酶体贮积症的新洞见。
本期《自然》在线发表了两篇关于TRPML1的论文,第二篇同样来自德克萨斯大学西南医学中心,主要负责人之一是李晓淳教授。李教授博士后期间的导师,洛克菲勒大学的诺贝尔生理学或医学奖得主Günter Blobel教授也是通讯作者之一。在这项研究中,研究人员公布了全长的人类TRPML1蛋白冷冻电镜结构。值得一提的是,这支团队同时获得了该通道蛋白“关闭”和“开启”时的结构。研究人员指出,这些结构揭露了TRPML通道蛋白的调控机理,有望带来治疗由TRPML1突变引起的溶酶体贮积症的新洞见。
 3、刘澎涛博士课题组
3、刘澎涛博士课题组
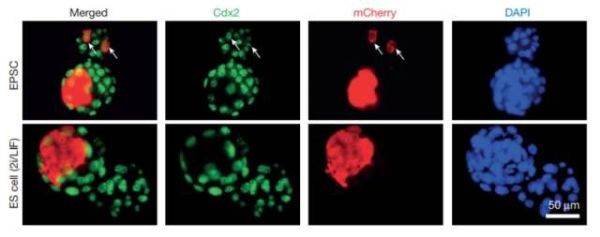
Establishment of mouse expanded potential stem cells
 常规的干细胞分为两类——胚胎干细胞与诱导多能干细胞。理论上说,它们能分化成多种细胞类型,但之前的研究却表明,这两类细胞可以分化出的细胞类型有限——依然有一些细胞无法从这两类干细胞中获得。来自英国威康信托桑格研究所的刘澎涛教授团队开发出了一种新技术。他们生成了小鼠的拓展分化潜能干细胞(expanded potential stem cells),它们与胚胎最初的几个细胞性质极为接近,能形成任意细胞类型。刘澎涛教授团队也相信,这一技术有望应用于其他哺乳动物,包括人类。
常规的干细胞分为两类——胚胎干细胞与诱导多能干细胞。理论上说,它们能分化成多种细胞类型,但之前的研究却表明,这两类细胞可以分化出的细胞类型有限——依然有一些细胞无法从这两类干细胞中获得。来自英国威康信托桑格研究所的刘澎涛教授团队开发出了一种新技术。他们生成了小鼠的拓展分化潜能干细胞(expanded potential stem cells),它们与胚胎最初的几个细胞性质极为接近,能形成任意细胞类型。刘澎涛教授团队也相信,这一技术有望应用于其他哺乳动物,包括人类。
 4、邵峰博士课题组
4、邵峰博士课题组
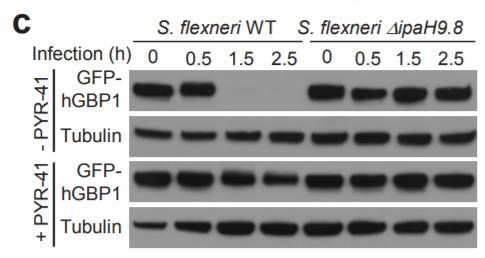
Ubiquitination and degradation of GBPs by a Shigella effector to suppress host defence
 GBP蛋白能介导细胞自主的抗微生物防御机制。在这篇研究中,北京生命科学研究所的邵峰教授课题组发现,一种叫做志贺氏痢疾杆菌(Shigella flexneri)的微生物在感染后,能诱发人类GBP1蛋白的快速降解。进一步的研究发现,一种叫做IpaH9.8的分子在其中起到了关键作用。该分子能直接靶向人GBP1蛋白,在Lys-48位点进行泛素化。事实上,这种分子能靶向多种GBP蛋白,影响到抗微生物的防御机制。这一发现有助于我们更好地理解GBP蛋白介导的免疫力。
GBP蛋白能介导细胞自主的抗微生物防御机制。在这篇研究中,北京生命科学研究所的邵峰教授课题组发现,一种叫做志贺氏痢疾杆菌(Shigella flexneri)的微生物在感染后,能诱发人类GBP1蛋白的快速降解。进一步的研究发现,一种叫做IpaH9.8的分子在其中起到了关键作用。该分子能直接靶向人GBP1蛋白,在Lys-48位点进行泛素化。事实上,这种分子能靶向多种GBP蛋白,影响到抗微生物的防御机制。这一发现有助于我们更好地理解GBP蛋白介导的免疫力。
5、Jin Billy Li博士课题组
Dynamic landscape and regulation of RNA editing in mammals
由腺苷到肌苷(A-to-I)的转变是常见而保守的RNA编辑手段,由ADAR酶介导。这一编辑能改变RNA中的特定核苷酸,增加了转录组的多样性。尽管研究人员们已经找到了多个编辑位点,但大部分位点的编辑程度,以及这些编辑如何调节生物学进程,依旧是个未解之谜。斯坦福大学Jin Billy Li教授的团队在这篇文章中,分析了8551个人类样本中的编辑情况。他们发现ADAR1主要负责重复位点,而ADAR2主要负责非重复位点。有趣的是,没有催化活性的ADAR3还扮演了抑制者的角色。研究人员们指出,他们的发现带来了关于A-to-I转变的新洞见。
 参考文献:
参考文献:
1、Qingfeng Chen,Ji She,Weizhong Zeng et.al. Structure of mammalian endolysosomal TRPML1 channel in nanodiscs. Nature (2017) doi:10.1038/nature24035
2、Philip Schmiege, Michael Fine,Günter Blobel& Xiaochun Li.Human TRPML1 channel structures in open and closed conformations.Nature (2017) doi:10.1038/nature24036
3、Jian Yang,David J. Ryan,Wei Wang et.al.Establishment of mouse expanded potential stem cells.Nature (2017) doi:10.1038/nature24052
4、Peng Li,Wei Jiang,Qin Yu et.al.Ubiquitination and degradation of GBPs by a Shigella effector to suppress host defence.Nature (2017) doi:10.1038/nature24467
5、Meng How Tan,Qin Li,Raghuvaran Shanmugam et al.Dynamic landscape and regulation of RNA editing in mammals.Nature 550, 249–254 (12 October 2017) doi:10.1038/nature24041


{replyUser1} 回复 {replyUser2}:{content}