全球“突破性癌症疗法”将在中国落地 ,癌症被治愈的希望之光
8 月 30 日,美国 FDA 正式批准诺华公司突破性 CAR-T 疗法 Kymriah 上市。Kymriah 成为 FDA 批准的首个 CAR-T 疗法,也是 FDA 批准的第一个免疫细胞药物。
 至此,CAR-T 疗法进入了一个全新的历史阶段。
至此,CAR-T 疗法进入了一个全新的历史阶段。
人们已经看到了癌症将被治愈的希望之光,而 FDA 的首张上市通行证花落诺华,同样加速了业内公司激烈的竞争态势。当国外的 CAR-T 疗法大放异彩的时候,国内的癌症患者也对这些产品有极大的需求,要知道,中国的癌症患者的数量大概是美国患者的 4 倍。
在中国,医药巨头复星医药已大步跨入细胞疗法领域:今年 1 月 10 日,复星医药与全球领先的生物技术公司 Kite Pharma (下文简称“凯特”)就共同设立中外合作经营企业达成共识,同年 4 月,由复星医药及凯特分别持股 50% 的复星凯特生物科技有限公司(以下简称“复星凯特”)完成设立。该笔交易也使得复星医药进入细胞免疫疗法第一梯队。 作为全球 CAR-T 研究的领军企业,凯特药业曾入选 2017 年度的“《麻省理工科技评论》本年度全球 50 大最聪明公司”,在榜单上位列第 7 名,上榜的关键词则是“39%——严重的淋巴癌者,在接受过一次凯特药业的治疗之后的 6 个月没有任何复发迹象的研究参与者比例”。
作为全球 CAR-T 研究的领军企业,凯特药业曾入选 2017 年度的“《麻省理工科技评论》本年度全球 50 大最聪明公司”,在榜单上位列第 7 名,上榜的关键词则是“39%——严重的淋巴癌者,在接受过一次凯特药业的治疗之后的 6 个月没有任何复发迹象的研究参与者比例”。
另一个好消息是,作为全球 CAR-T 研究的领军企业,凯特的 CAR-T 治疗产品 KTE-C19 很可能于今年下半年获批,成为全球第二个上市的 CAR-T 药物,且为第一款治疗复发难治非霍奇金淋巴瘤适应症的 CAR-T 药物。
而复星凯特已经获了 KTE-C19 的中国商业化权利(根据本次合作约定,包括中国大陆、香港及澳门),将为中国的淋巴癌患者带来全球领先的治疗手段。除此之外,复星凯特同样持有 Kite Pharma 后续两个产品(KITE-439、KITE-718)授权许可的优先选择权。
全球涌现的并购与合作
今年 8 月,复星医药和凯特的合作迎来一个小插曲:28 日,美国制药巨头吉利德以 119 亿美元现金收购凯特。
本来,按照 CAR-T 疗法的市场热度,制药公司为其“一掷千金”应该并不稀罕,但不少制药巨头更多偏向于以合作的形式进军 CAR-T 领域,吉利德如此干脆地以 119 亿美元现金收购凯特,确实有让人感到惊喜和意外。
 复星凯特CEO王立群,毕业于中国科学技术大学,获得美国巴尔的摩马里兰大学分子生物学博士学位,辛辛那提萨维尔大学MBA。加入复星凯特前在西比曼生物科技担任COO
复星凯特CEO王立群,毕业于中国科学技术大学,获得美国巴尔的摩马里兰大学分子生物学博士学位,辛辛那提萨维尔大学MBA。加入复星凯特前在西比曼生物科技担任COO
而作为复星凯特的 CEO,王立群表示:
“CAR-T 确实是一个划时代的产品,一定会被资本或者其他大公司看中。吉利德抢先一步,其实不光是看好凯特的首个产品,也是对凯特整个研发管线后续各种产品的一种信心,是对它整个研发方向跟技术平台的一种认可。”
而凯特在内部宣布该消息的当天立刻召开了全体员工大会,吉利德的 CEO 也出席了,复星凯特同样有代表参加,当时就有人问此次并购对复星凯特的影响,吉利德 CEO 明确表示不会对复星凯特有任何负面影响,并表示吉利德也需要像复星这样的既了解当地文化又懂当地市场的中国合作伙伴。
吉利德看好凯特后期发展的空间,从这一点来看,他们无疑会保持凯特的独立运作,这就意味着复星和凯特的合作不会有太大改变。
 目前,凯特拥有 CAR-T 和 TCRT 两大技术平台。复星凯特引进的 KTE-C19 产品是以 CD19 为靶点的 CAR-T 产品,CD19 是目前免疫细胞治疗技术开发最为成熟的靶点,主要用于 B 细胞淋巴瘤及白血病的治疗。
目前,凯特拥有 CAR-T 和 TCRT 两大技术平台。复星凯特引进的 KTE-C19 产品是以 CD19 为靶点的 CAR-T 产品,CD19 是目前免疫细胞治疗技术开发最为成熟的靶点,主要用于 B 细胞淋巴瘤及白血病的治疗。
KTE-C19 已经完成了关键性的 II 期注册临床试验。其临床试验结果显示,KTE-C19 大幅提升了复发/难治性淋巴瘤患者的完全缓解率,相比较常规挽救性治疗手段,完全缓解率从 8% 提高到了 39%。其中最早使用该治疗的患者,完全缓解的持续时间目前达到了 22 个月,且处于持续缓解状态,接近治愈。
复星医药通过和凯特在国内合作,获得了 KTE-C19 及后续产品在中国的相关权益,也迈入了全球免疫细胞研究的最前沿战场。
 在细胞疗法领域,类似于吉利德收购凯特、复星医药与凯特合作的事件似乎将越来越频繁。咨询公司麦肯锡也认为,制药行业已确信,在肿瘤免疫治疗方面的合作十分必要。众所周知,CAR-T 本身商业化周期比较漫长,技术本身还有进一步提升的空间和需求,这也是全球各公司均正不遗余力地寻求多方合作的最主要原因之一。
在细胞疗法领域,类似于吉利德收购凯特、复星医药与凯特合作的事件似乎将越来越频繁。咨询公司麦肯锡也认为,制药行业已确信,在肿瘤免疫治疗方面的合作十分必要。众所周知,CAR-T 本身商业化周期比较漫长,技术本身还有进一步提升的空间和需求,这也是全球各公司均正不遗余力地寻求多方合作的最主要原因之一。
谁能更快获得新突破,谁就更有机会抢占癌症免疫疗法的至高点,这一点在中国市场也不例外。
除了复星医药与凯特设立复星凯特公司外,早在 2016 年 4 月,Juno 就与药明康德成立上海药明巨诺生物科技有限公司,合作开发 CAR-T 技术,其他诸如恒瑞医药、中源协和、三生制药等公司也多有布局。
而对于像凯特这样的新兴公司来说,吉利德没有从事任何细胞治疗研究的经验,也许并不能够提供太多技术方面的支持,但是其雄厚的资金和丰富的产品商业化经验无疑能够提供强大的保障。
从 2013 年末到现在,CAR-T 这个新领域得到了前所未有的关注,科学研究、公司合作以及资金注入等活动一直没有停歇。接下来,我们还将看到越来越多这样的业内并购和合作事件,相信多方、多维度地参与将会为 CAR-T 带来更多新进展。
“突破性疗法”面市之艰辛
在 8 月,引爆整个 CAR-T 行业的,除了吉利德收购凯特,还有一件事情是诺华的疗法成为全球首个获批的免疫疗法。
目前,凯特的 CAR-T 疗法 KTE-C19 正处于 FDA 审评阶段,PDUFA 预定审批期限是 2017 年 11 月 29 日,有望成为 FDA 批准的第一个治疗非霍奇金淋巴瘤(包括弥漫性大 B 细胞淋巴瘤、转化型滤泡性淋巴瘤、原发纵隔 B 细胞淋巴瘤)的 CAR-T 产品。
尽管凯特的 KTE-C19 未能成为“史上首个通过 FDA 批准的 CAR-T 疗法”,但这也丝毫没有影响复星凯特将这款产品落地中国的信心和决心。
 “凯特和诺华申报的产品并不是针对同一个适应症。并且凯特不管在生产工艺还是临床效果或者安全性上都有着良好的表现。诺华的产品获批了,凯特的产品获批也不存在什么顾虑”,王立群说。
“凯特和诺华申报的产品并不是针对同一个适应症。并且凯特不管在生产工艺还是临床效果或者安全性上都有着良好的表现。诺华的产品获批了,凯特的产品获批也不存在什么顾虑”,王立群说。
相较而言,诺华的 CAR-T 产品开发速度稳定,但后续的研发管线其实并不多,而凯特在这一点上则占优势:凯特具有丰富的 CAR-T 产品研发管线。与此同时,凯特也意识到了全球开发进程的重要性,并在不断地寻求合作:除了与复星医药合作成立复星凯特外,他们还与日本第一三共合作,成功转让 KTE-C19 的日本市场权利。
但是,诺华获批确实给整个行业注入一剂强心剂:CAR-T 的前景已经非常明确了,人们对此的顾虑能被大大消除。当然,早在此次获批之前,CAR-T 在国内也是数一数二的医疗投资热门方向。
从中国监管部门的角度来看,尽管国内尚未批准一个 CAR-T 注册申请,但 FDA 的这次实践为他们的审批的流程、制度、监管方式提供了经验。
目前,诺华、凯特和 JUNO 的 CAR-T 技术都已经取得 FDA“突破性疗法”的地位。“突破性疗法”实际上是美国政府为那些在早期研究中显示出良好前景的技术设置的“绿色通道”,这些前景大好的疗法可以借此途径尽快进入市场,而不必完成传统的 3 个阶段(Ⅰ~Ⅲ期临床研究)的开发计划。
王立群认为,诺华获批实际上也再次提醒了我们,这是一次中国与国际接轨的好机会,而中国的监管部门也肯定会将国内国情考虑进去。
 诺华
诺华
事实上,无论从 CAR-T 的研发创新还是临床研究数量上,在全球范围内中国都仅次于美国。尽管目前 CAR-T 产品仍没有一家企业在中国申报, 但我们看到,中国对于细胞免疫疗法正采取加快推进的政策态度,而不再是以往的观望和保留。比如说,2016 年 12 月 16 日,国家食品药品监督管理总局药品审评中心就对外发布了关于《细胞制品研究与评价技术指导原则》(征求意见稿)的通知,根据征求意见稿,细胞制品未来将按药品评审原则进行管理。
这是 CAR-T 技术从学术迈向产业化转移的关键一步,但是,并不意味研发结束,因为后续还面临着诸多种挑战。
在我们的常识中,药物就是由药厂统一生产的质量均一稳定可控的制品。然而 CAR-T 作为一种个体化的活细胞产品,其制备流程的复杂和困难程度是显而易见的:首先需要从每位患者体内抽取细胞,接下来是输送到合格的生产基地进行基因工程改造,随后送回患者所在医院,经过改造后的细胞再回输患者体内,之后,医院还得对回输后各种可能的不良反应进行严密监控……
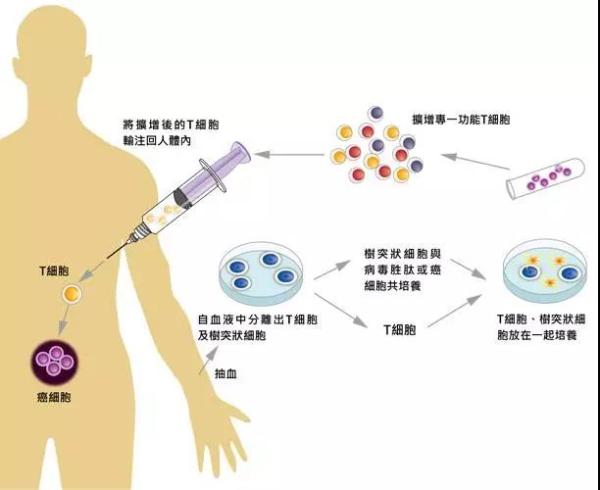 CAR-T细胞疗法
CAR-T细胞疗法
以上一整套流程对 CAR-T 的商品化过程提出了许多严峻挑战,例如说不同患者体内的细胞如何进行生产和质控、医院与细胞改造基地之间如何安全可靠地运输细胞等等。
“CAR-T 作为一个药品进行开发的背后异常艰辛,无论是技术上的难度、质量控制还是工艺流程,这都是相当花钱和花时间的”,王立群说。
其产业链会变得越来越长,越来越完整,而更多更具体的问题也会随之不断涌现,一方面需要监管部门尽快制定合理的管理条例,另一方面要求公司尽快完善 CAR-T 的生产工艺。这两个过程都不能一蹴而就。
王立群说:“虽然我们目前还不能很确定首款产品在中国上市的具体日期,但我们先尽快做临床,并要想方设法尽快在中国生产出合格的、跟凯特一样的产品。”
“天价”疗法?
“治愈”通常不是肿瘤学家们常用的词,以往他们最乐观的说法也就是“缓解”,因为大多数癌症治疗基本难以达到他们早期的承诺。
但 CAR-T 细胞免疫疗法和大多数的癌症治疗方法不一样,这种革命性癌症疗法确实有着让肿瘤病人治愈的可能。
而对于广大癌症患者来说,价格的大山在一定程度上挡住了这种疗法可能为他们带来的曙光。
 《华尔街日报》对诺华 Kymriah 定价争议的报道
《华尔街日报》对诺华 Kymriah 定价争议的报道
这一点我们从诺华的疗法获批后价格成为最大争议点就能窥见。这项被称为 Kymriah(嵌合抗原受体疗法)的个性化免疫疗法的单次治疗价格为 47.5 万美元,消息出来之后,外界对这一疗法价格高昂的争议不绝于耳。
但事实上,这个价格也显著低于很多分析师所预测的 60 万-75 万美元。毕竟,对于经历了十年增长乏力的制药业来说,这一“天价”方案无疑能催生了新的际遇:据 Coherent Market Insights 分析,CAR-T 疗法预计在 2028 年全球市场规模将达到 85 亿美元,未来的市场空间预计在 350 亿美元-1000 亿美元之间。
不过,许多业内人士并不认为这样的定价不合理,王立群就是其中一位。据他介绍,在癌症治疗手段上,比如说免疫检查点抑制剂的,一年下来花费也要二三十万,联合治疗的话价格还会更高,还不一定能治愈,而 CAR-T 实际上是很有可能终身治愈的。
他也承认,CAR-T 疗法的价格目前仍有较大的压缩空间。一旦可以实行工业化生产,细胞免疫疗法的费用无疑会大大降低。另外,随着 CAR-T 领域玩家越来越多,竞争同样会催使全世界的运营者探寻一种更合理、更高效和成本可控的细胞生产条件。这一类成本极高的新兴产品,究竟如何合理定价以从而实现患者与公司的双赢,同样也是全球相关公司正在头疼的问题。
而对于复星凯特的第一款产品的定价,王立群透露,复星凯特将结合中国市场的情况给出一个合理的价格。
“这个价格未来 5 到 10 年是有可能下降的”,王立群笃定地说。
除了价格上的讨论外,有一种说法也随着 CAR-T 的走红而甚嚣尘上,那就是 CAR-T 将横扫抗肿瘤技术领域,取代几乎所有传统的癌症治疗手段。
对于这种说法,王立群并不认同:“CAR-T 永远不会‘一家独大’。在肿瘤治疗的某些领域,这种技术可能是最优解,但不是所有的肿瘤都适合用细胞治疗来做。化疗、抗体药、细胞治疗作为肿瘤治疗的三个主要手段会共存很长一段时间。”


{replyUser1} 回复 {replyUser2}:{content}