发现 > 资讯
FDA发布2019年度药品指南工作计划
·
·
·

美国FDA作为全球药品监管的权威机构和各类法规指南的风向标,一直被各国药政机构所关注,也是全球制药行业持续关注的热点机构。每年年初,FDA会对本年度需要新建和修订的指南发布工作计划,向社会公众和制药行业发出明确的引领信号;这份工作计划一直是制药行业所高度关注的。
在2019年3月5日,FDA发布了2019年度药品指南工作计划,题目是《Guidance Agenda-New & Revised Draft Guidances-CDER Plans to Publish During Calendar Year 2019》。笔者深夜加班,为中国制药行业同仁介绍一下2019年度FDA要做哪些工作,哪些新指南要面世,哪些指南会修订。
总体介绍
在这份2019年工作计划汇总,FDA新建和修订指南的业务范围覆盖生物类似药、临床医学、临床药理学、临床统计学、组合产品、产品研发工具、药品安全、电子申报、仿制药、标签、制药质量/微生物、制药质量/CMC、药理学/毒理学、规程、罕见病等15个专题。具体指南分布情况参见下表:
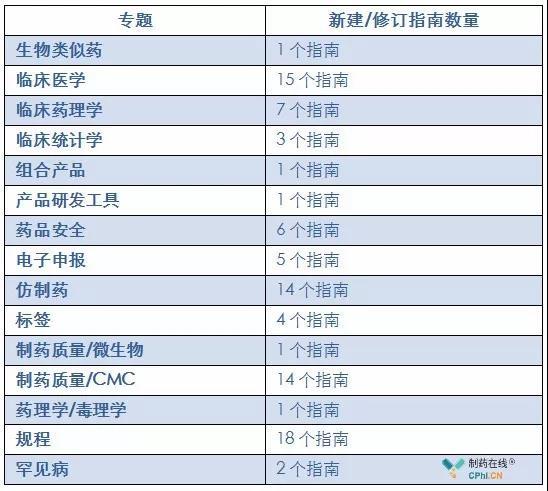
专题介绍
对于中国制药行业关注度更高的仿制药、制药质量/CMC专题,笔者详细介绍如下:
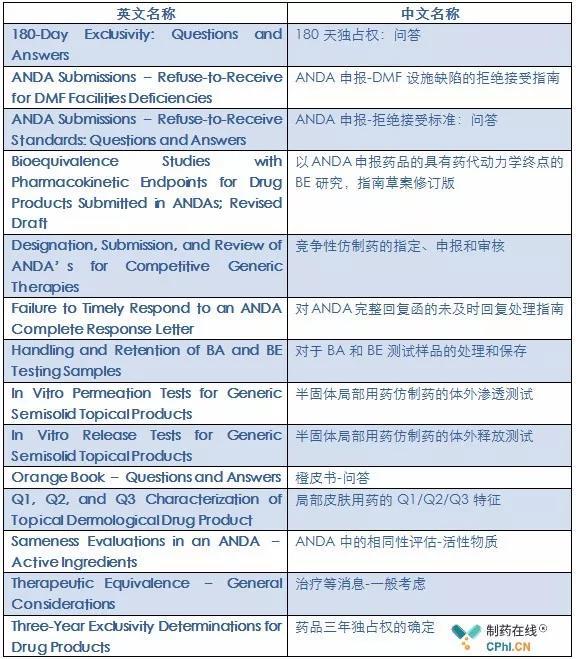
第一、 仿制药专题
在这部分,FDA将新建/修订14个指南。参见下表:
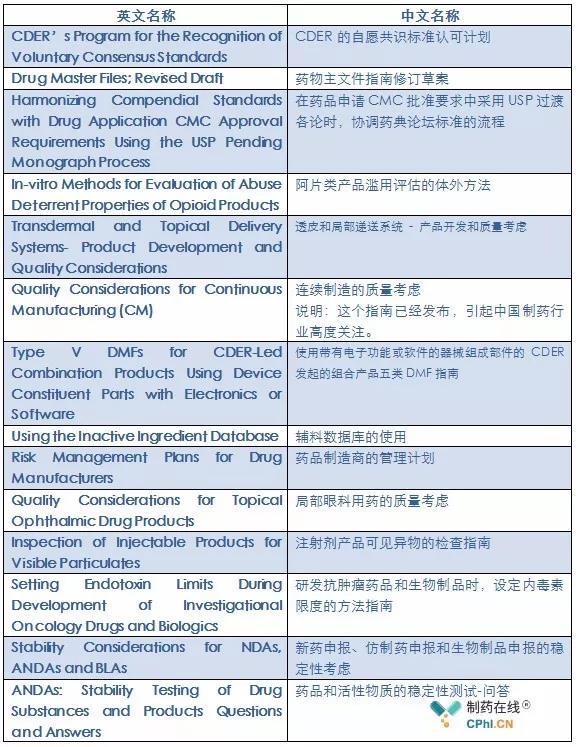
第二、 制药质量/CMC专题
在这部分,FDA将新建/修订14个指南。参见下表:
综上所述,FDA将在2019年度继续指点江山,引领潮流,持续引领国际制药行业法规和技术发展的最新放行。希望这些信息,可以为中国制药行业提供些许帮助。
来源:制药在线
版权及免责声明:本网站所有文章除标明原创外,均来自网络。登载本文的目的为传播行业信息,内容仅供参考,如有侵权请联系答魔删除。文章版权归原作者及原出处所有。本网拥有对此声明的最终解释权。


{replyUser1} 回复 {replyUser2}:{content}