《细胞》子刊:T细胞深入癌症组织内部,不得不靠脂肪酸代谢产能
肿瘤一入深似海,各项技能都归零。
上面那句话,是答答给T细胞的抗癌表现做的深刻总结。
近日,来自美国Wistar研究所的Hildegund Ertl教授和华人科学家Zhang Ying博士共同揭示,肿瘤内T细胞的处境不仅悲惨,简直是堪称悲壮。
 Hildegund Ertl教授
Hildegund Ertl教授
我们都知道肿瘤是个变态而邪恶的组织,里面低糖、低氧,正常的细胞基本不能适应这种变态的环境。需要消耗大量能量才能发挥杀敌技能的T细胞就更难适应这种环境了。
Zhang博士发现,接受激发免疫系统的药物治疗之后,会有大量的被激活的杀伤性T细胞进入肿瘤,但是大约30天之后,肿瘤内的杀伤性T细胞数量降低了90%左右。大量的T细胞都去哪儿了?默默离开了?还是英勇战死了?研究人员不清楚。
但是研究人员发现,剩下那部分还在坚守的杀伤性T细胞,为了保存最后的「革命」的火种,竟改变了自己的「饮食」习惯,从靠葡萄糖供能的代谢策略,转向脂肪酸代谢供能,在夹缝里求生存。让人惊喜的是,当Zhang博士通过药物进一步激活T细胞脂肪酸代谢路径时,它们被唤醒了。这一重要研究于近日刊登在著名期刊《癌细胞》上[1]。
 Zhang Ying博士
Zhang Ying博士
实际上,去年12月份Dana-Farber癌症研究所[2]和宾夕法尼亚大学医学院团队[3],背靠背发在《科学》杂志上的两篇关于T细胞耗竭的重要研究已经指出,由于持续的抗原刺激,进入肿瘤里面的T细胞被重编程了,通俗的说,就是被「洗脑」了,不再有杀伤肿瘤的能力了。
他们的发现在一定程度上解释了免疫检查点抑制剂(PD-1和PD-L1抗体)治疗癌症响应率低,CAR-T治不了实体瘤的问题。但是他们没有回答这种T细胞的重编程是不是可以破除呢?或者我们再给它们编回去。如果可以,我们就可以全面解放T细胞,大幅提升免疫治疗的效果。
从Zhang博士的研究来看,这种重编程似乎是可以解开的。
Ertl教授表示,「关于T细胞耗竭的机制研究甚少,鉴于T细胞对癌症的免疫治疗至关重要,我们的结果会对提高免疫治疗的效率有重要意义!未来我们将会进行相应的测试,先对T细胞进行脂肪酸代谢预处理再转移到患者体内,以探究这样是否会延长T细胞的存活时间、改善其功能,最终使患者受益。」[4,5]
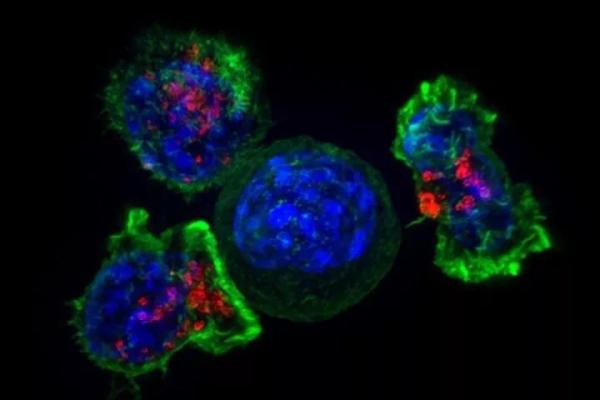 科学家们已经知道,肿瘤微环境中,T细胞的存在通常与更好的临床结果和患者对药物更好的响应率有关。
科学家们已经知道,肿瘤微环境中,T细胞的存在通常与更好的临床结果和患者对药物更好的响应率有关。
不过,T细胞想要发挥功能的前提,是要有足够的能量。通常情况下,葡萄糖会是细胞的首选能量来源,因为它会以极高的效率产生能量,以供细胞发挥各种功能。
然而,在肿瘤微环境中,由于血管较少,所以氧气、葡萄糖的供应明显不足。此外,肿瘤细胞疯狂地生长更加剧了低氧、低糖的状况。在这种情况下,T细胞想通过葡萄糖代谢来获取能量就困难重重了。
那么,面对此种困境,T细胞有没有别的招儿呢?这也是困扰Ertl教授团队的问题。
为了弄清楚这个问题,Ertl教授带领团队,首先给正常小鼠和携带B16-BrafV600E基因突变的黑色素瘤小鼠,接种两种腺病毒疫苗混合物,以刺激小鼠产生黑色素瘤相关抗原特异性(MAA)的T细胞和病毒抗原特异性(E7)的T细胞。接种疫苗,一方面可以减缓肿瘤生长的速度,另一方面,也可以观察肿瘤中T细胞的状况。
在接种后30天,携带基因突变的小鼠,其肿瘤中能够产生杀敌武器如颗粒酶、穿孔素、γ干扰素的杀伤性T细胞数量减少了90%左右,但是抑制T细胞功能的因子如PD-1、LAG3的表达却增加了。即T细胞确实是「疲惫」了,产生了T细胞耗竭现象。
 T细胞进入肿瘤后,在PPARa激动剂的刺激下,靠燃烧脂肪酸(FA)恢复战斗力
T细胞进入肿瘤后,在PPARa激动剂的刺激下,靠燃烧脂肪酸(FA)恢复战斗力
不过,庆幸的是,T细胞虽然是「疲惫」了,但是它所针对抗原的特异性并没有发生改变!研究人员推测,除了持续的抗原刺激外,一定还有其他因素驱动T细胞耗竭。
接下来的研究结果证实了他们的猜想:研究人员发现,肿瘤中的T细胞,不论是MAA-T细胞还是E7-T细胞,它们的低氧诱导因子1α(HIF1α)的表达都增加了。进一步的研究发现,HIF1α促进了LAG3的表达,而对PD-1的表达没有影响,同时,HIF1α还破坏了T细胞释放杀敌武器的功能。
也就是说,低氧环境下,是HIF1α的高表达导致了T细胞抗肿瘤功能的丧失!
更为有意思的是,研究人员发现,当把HIF1α基因敲除后,T细胞中除了与糖代谢发生改变外,促进脂肪酸代谢及摄取有关的关键转录因子,PPARα,表达也增加了。这让研究人员不禁怀疑,难道肿瘤中的T细胞,产能从高效的葡萄糖代谢转向相对低效的脂肪酸代谢了吗?
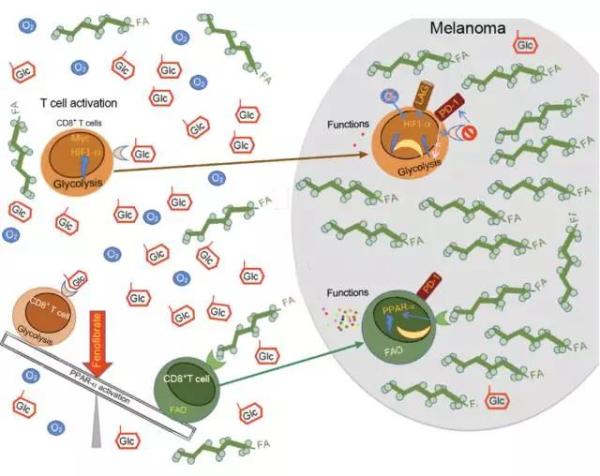 T细胞进入肿瘤后,在PPARa激动剂的刺激下,脂肪酸(FA)代谢能力增强
T细胞进入肿瘤后,在PPARa激动剂的刺激下,脂肪酸(FA)代谢能力增强
于是,研究人员采用液相色谱法,对基因突变小鼠肿瘤中的T细胞代谢情况情况进行了分析。他们发现,在接种后30天,肿瘤中的T细胞,糖代谢产物减少了,而脂肪酸代谢产物却增加了。
为了进一步验证这一结果,研究人员还对基因突变黑色素瘤小鼠不同时期肿瘤样本、黑色素瘤患者来源的异种移植物不同时期肿瘤样本、及转移性黑色素瘤患者肿瘤及血清样本,进行了脂肪酸水平的检测。结果均显示,在肿瘤进展期间,游离脂肪酸的水平持续升高。也就是说,T细胞依靠脂肪酸代谢供能确实是可行的。
综合这两项结果,我们可以简单的理解,面对肿瘤中低氧、低糖的恶劣环境,T细胞缺乏了葡萄糖供应,采取糖代谢功能行不通,被逼无奈,只好利用环境中越来越多的脂肪酸,通过脂肪酸氧化供能,以苟活于世。
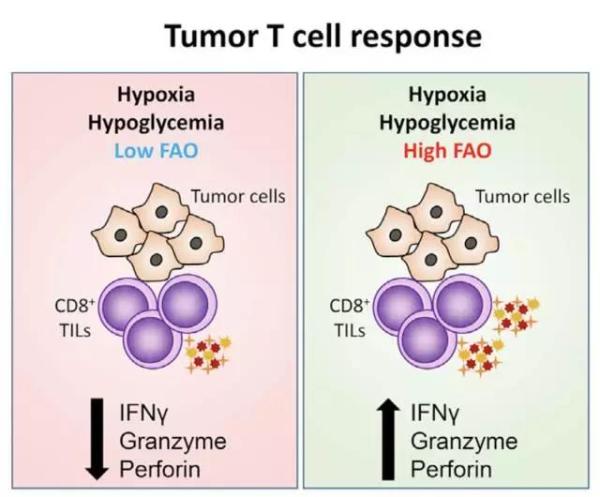 (左)在肿瘤低糖低氧的环境中,脂肪酸代谢弱,T细胞(紫色)的杀伤能力低
(左)在肿瘤低糖低氧的环境中,脂肪酸代谢弱,T细胞(紫色)的杀伤能力低
(右)在肿瘤低糖低氧的环境中,脂肪酸代谢强,T细胞(紫色)的杀伤能力强
那么增强脂肪酸氧化,能不能提高肿瘤微环境中T细胞的抗肿瘤功能呢?于是,研究人员每天给实验组小鼠喂食增加脂肪酸氧化的PPARa激动剂,对照组喂食稀释液;连续小鼠3周后再将小鼠脾脏取出,转移到黑色素瘤小鼠中,发现PPARa激动剂处理不但增强了T细胞的脂肪酸代谢,而且增强了T细胞抗肿瘤的功能。此外,研究人员还证实,PPARa激动剂是特异性针对肿瘤微环境中的T细胞的,而对其他的T细胞不起作用。
最后,研究人员又比较了预先采用PPARa激动剂处理T细胞同时联合PD-1抑制剂治疗黑色素瘤小鼠的效果,发现二者联合使用,延缓了肿瘤的进展,并且阻止了约50%的小鼠肿瘤的生长。
这项研究让我们看到,面对肿瘤微环境中的恶劣条件,T细胞能够另辟蹊径,借助脂肪酸氧化产能,求得生存。倘若我们给它提供帮助,增加它的脂肪酸氧化产能,同时把肿瘤细胞在它身上施的魔咒PD-1解除,那么,T细胞将再次扛起杀死肿瘤细胞的武器,冲锋陷阵!这不管是对于提高免疫检查点抑制剂的治疗效果、还是改善CAR-T治疗实体瘤方面都是具有重要意义的[6]!
参考资料:
[1] Zhang Y, Kurupati R, Liu L, et al. Enhancing CD8+ T Cell Fatty Acid Catabolism within a Metabolically Challenging Tumor Microenvironment Increases the Efficacy of Melanoma Immunotherapy[J]. Cancer Cell, 2017, 32(3): 377-391. e9.
[2]Sen DR, Kaminski J, Barnitz RA, Kurachi M, Gerdemann U, et al. 2016. The epigenetic landscape of T cell exhaustion. Science 354:1165-9
[3]Pauken KE, Sammons MA, Odorizzi PM, Manne S, Godec J, et al. 2016. Epigenetic stability of exhausted T cells limits durability of reinvigoration by PD-1 blockade. Science 354:1160-5
[4]https://www.wistar.org/news-and-media/press-releases/modulating-t-cell-metabolism-uncovers-new-technology-enhancing-immun-0
[5] Bradley CA. 2017. Immunotherapy: CD8+ T cells [mdash] burn fat, get fit. Nat Rev Cancer advance online publication
[6] Bailis W, Shyer J A, Chiorazzi M, et al. No Oxygen? No Glucose? No Problem: Fatty Acid Catabolism Enhances Effector CD8+ TILs[J]. Cancer Cell, 2017, 32(3): 280-281.


{replyUser1} 回复 {replyUser2}:{content}