2019年带量采购政策下,各地落实仿制药一致性评价的情况

国家及地方继续推进“4+7”带量采购政策落地,并出台相关实施细则以保证政策实施效果,12部委联合出台“工作方案”保障仿制药供应。2019年初医药界继续奏响促创新、保质量、降价格、惠民生的“主旋律”。今年6月底前,第一批鼓励仿制的药品目录将发布。
一、国家及地方继续推进81个带量采购政策落地
2019年1月17日,国务院发布《国家组织药品集中采购和使用试点方案》。从通过质量和疗效一致性评价(含按化学药品新注册分类批准上市,简称一致性评价)的仿制药对应的通用名药品中遴选试点品种,国家组织药品集中采购和使用试点,降低药价,减轻患者药费负担。同时,降低企业交易成本,净化流通环境,改善行业生态;引导医疗机构规范用药,支持公立医院改革;探索完善药品集中采购机制和以市场为主导的药品价格形成机制。
2019年1月25日,卫健委发布《关于做好国家组织药品集中采购中选药品临床配备使用工作的通知》,要求各部门高度重视中选药品的配备使用工作,提高中选药品的合理使用水平,并做好中选药品临床使用情况监测。上海、江苏、天津等地出台相关政策明细内容、进度阶段、监管执行等,以保证政策的落实。各地细则见表1。

表1 各地“4+7“带量采购实施细则
二、12部委齐治“药荒”,保障仿制药的供应。
2018年12月29日,国家卫健委、国家发改委等12部委联合发布了一份重要通知——《关于印发加快落实仿制药供应保障及使用政策工作方案的通知》(《通知》),加快落实《国务院办公厅关于改革完善仿制药供应保障及使用政策的意见》,并提出了切实可行的措施,公布了未来7项重点工作任务:
(1)及时发布鼓励仿制的药品目录;(2)加强仿制药技术攻关;(3)完善药品知识产权保护;(4)加快提高上市药品质量;(5)促进仿制药替代使用;(6)深化医保支付方式改革;(7)加强反垄断执法。
为贯彻《通知》的精神,各地依据实际情况纷纷制定具体的实施方案:
山东省药品监督管理局联合山东省财政厅制定《山东省省级仿制药质量和疗效一致性评价补助资金管理办法》,推动更多仿制药品种纳入国家基本药物目录。
福建省发布《福建省人民政府办公厅关于改革完善仿制药供应保障及使用政策的实施意见》,提出了促进仿制药研发、提升仿制药质量疗效和完善支持政策等具体方针。
云南省发布《云南省人民政府办公厅关于改革完善仿制药供应保障及使用政策的实施意见》,除了提出了促进仿制药研发、提升仿制药质量疗效和完善支持政策等具体方针,还强调落实税收优惠政策、推动仿制药产业国际化、推进药品价格改革等举措。
三、仿制药落实情况分析
1.各地区一致性评价通过情况
截至2019年3月中旬,已有21个省(市、自治区)企业的产品通过了仿制药一致性评价,其中产品通过数量排TOP 3的是江苏省、浙江省和四川省,通过产品数量共63个,占全部通过量的47%;其他省(市、自治区)的产品通过情况见图1。
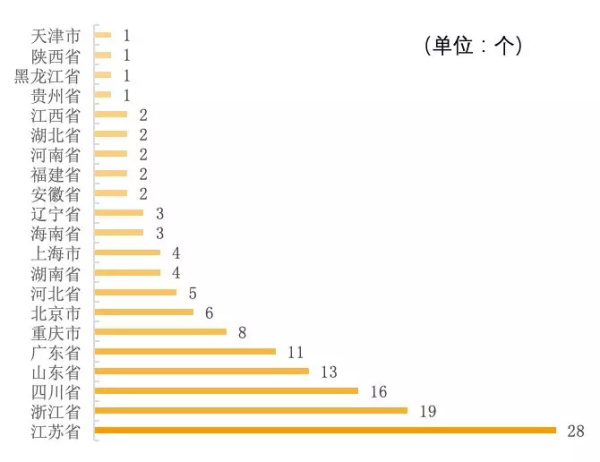
图1 全国各省(市、自治区)通过仿制药一致性评价产品数量
2.品种一致性评价通过情况
截至2019年3月22日,全国已通过仿制药一致性评价药品达到134个,涉及产品81个,其中已有3家及以上企业通过一致性评价的产品数为14个,占全部产品的17%;仅有1家企业通过一致性评价的产品数为55个,占全部产品的68%。
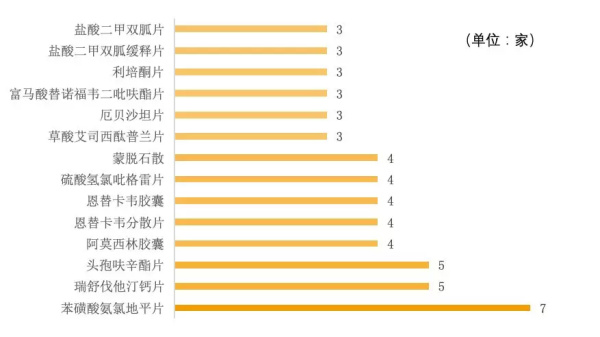
图2 已有3家及以上企业通过一致性评价的产品
通过评审企业最多的产品为苯磺酸氨氯地平片,共有7家企业;该产品为国家基药目录、国家医保目录(甲类)品种,主要用于治疗高血压及冠心病等。2017年氨氯地平在中国公立医疗机构终端销售额为56.89亿元。
其次,瑞舒伐他汀钙片通过企业为5家,是目前最新的他汀类药物,能够有效降低血脂、逆转动脉粥样斑块、降低动脉粥样硬化炎性指标,能够有效治疗心脑血管。2017年国内瑞舒伐他汀钙片产品的市场规模突破60亿元。
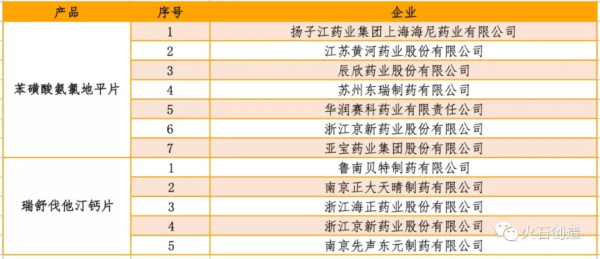
表2 通过仿制药一致性评价的药品数量排前2位的产品及企业
3.企业一致性评价通过情况
截至2019年3月22日,全国已有75家企业的产品通过仿制药一致性评价,其中已有3个及以上产品通过一致性评价的企业数为12家,占全部通过企业的16%。12家企业通过评审产品占全部过审产品的43%;仅有1家个产品通过一致性评价的企业有49家,占全部企业数的65%。
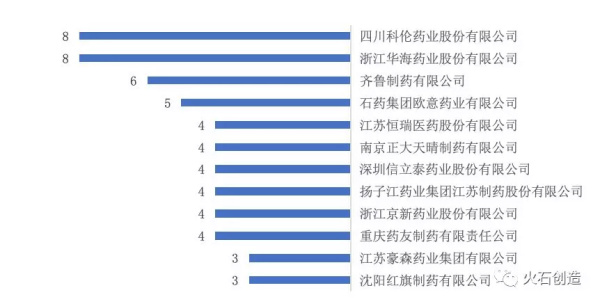
图3 已有3个及以上产品通过一致性评价的企业
截至2019年3月中旬,全国仿制药一致性评价完成情况领先的企业分别为浙江华海和四川科伦药业股份有限公司,其中浙江华海2017年通过评审的产品有7个、2018年通过评审的有1个、2019年暂无产品过审。四川科伦2018年通过评审的产品有4个、2019年过审的有3个,且7个产品过评时间相对接近。见表3。
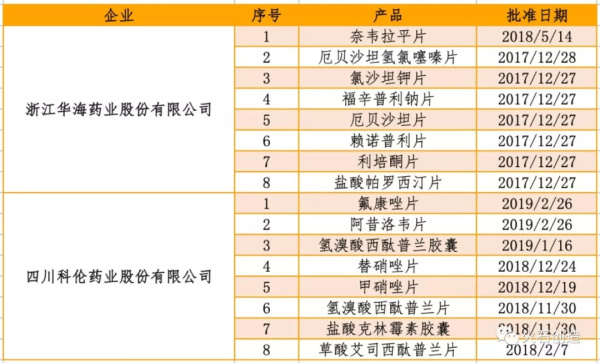
表3 浙江华海和四川科伦药业股份有限公司仿制药一致性评价完成情况
4.产品一致性评价通过进度
截至2019年3月中旬,2018年过评产品数量最多,有90个,占全部过评产品数量的69%。2019年仅第一季度就已有31个产品通过评审,同比2018年第1季度,实现了5倍的评审通过速度。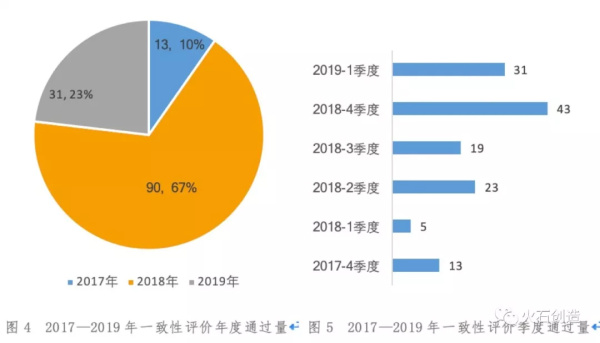
5.2019年一致性评价通过预测
截至2019年3月中旬,CDE受理中的在评品种为589个,其中2018年提交的有260个,2019年第一季度提交的有329个。自2019年开年以来,仿制药一致性评价呈爆炸式增长,且在2019年1月达到了顶峰。见图6。
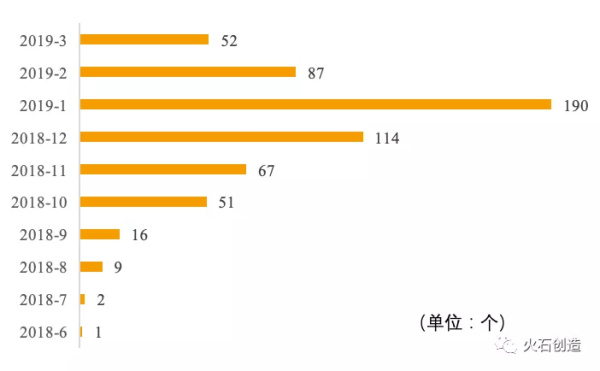
图6 近两年一致性评价在评品种受理进度分布图
递交申请的地区分布情况来看,当前共26个省(市、自治区)的企业递交了申请,其中新增省份有陕西省、云南省、青海省、吉林省和内蒙古自治区。在药品数量方面,依然是江苏省最多,药品数量有108个;其次为山东、浙江、广东和上海等,未来一定时期内可通过评审的产品数量较多。见图7。
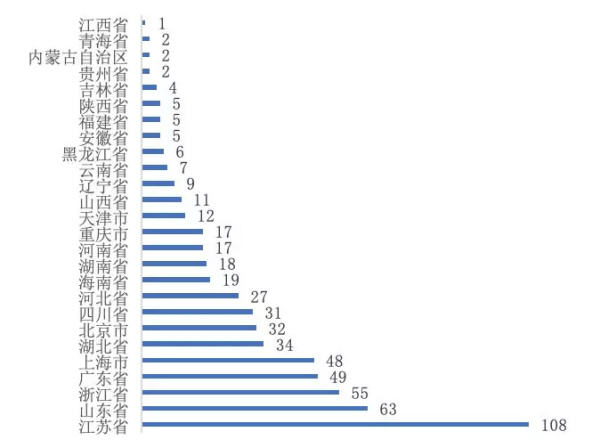
图7 不同省份企业申请评审的药品数量
来源:火石创造 作者:灰灰
来源: 火石创造
版权及免责声明:本网站所有文章除标明原创外,均来自网络。登载本文的目的为传播行业信息,内容仅供参考,如有侵权请联系答魔删除。文章版权归原作者及原出处所有。本网拥有对此声明的最终解释权。


{replyUser1} 回复 {replyUser2}:{content}