Nature基因编辑最新成果:无需切割DNA也能自由替换ATGC
基因编辑算是近几年来生命科学领域最热门的话题了,每一次技术的进步都会引起人们广泛的关注。尽管基于CRISPR–Cas9的基因编辑技术看上去已经相对较为成熟,而且被世界范围内很多实验室使用,然而科学家基于CRISPR–Cas9开发更好、更实用的基因编辑技术的脚步远没有停歇。
10月25日,来自哈佛大学化学与化学生物学系、HHMI以及Broad Institute的David Liu教授实验室在Nature杂志上以长文形式(Article)发表了题为“Programmable base editing of A•T to G•C in genomic DNA without DNA ”的突破性成果,报道了一种新型腺嘌呤碱基编辑器 (ABE),它可以将A•T碱基对转换成G•C碱基对,加之此前报道的将G•C碱基对转换成T•A 碱基对的成果,该技术首次实现了不依赖于DNA断裂而能够将DNA四种碱基A、T、G、C进行替换的新型基因编辑技术。这一突破性技术成果在未来将有望更广泛用于纠正某些引起遗传疾病的单碱基突变,摆脱了以往仅限于将G•C碱基对转换成T•A 碱基对的束缚。
 所谓不依赖于DNA链断裂的基因编辑技术,实际上又可称之为单碱基基因编辑技术。事实上,自2016年4月开始,以David Liu、Akihiko Kondo以及上海交大常兴实验室为代表的好几个团队就相继在Nature、Science、Nature Methods杂志上首次报道了不同类型的单碱基基因编辑系统【1-3】。不同的是David Liu实验室基于的是胞嘧啶脱氨酶APOBEC1(能催化C脱氨基变成U,而U在DNA复制过程中会被识别成T)和尿嘧啶糖基化酶抑制剂UGI(能防止尿嘧啶糖基化酶将U糖基化引起碱基切除修复)开发了第二代和第三代单碱基编辑系统APOBEC-XTEN-dCas9-UGI (BE2)和APOBEC-XTEN-Cas9n-UGI(BE3)【1】;而Akihiko Kondo实验室则基于七鳃鳗的胞嘧啶脱氨酶PmCDA1开发了dCas9-PmCDA1-UGI和Cas9n-PmCDA1-UGI单碱基编辑系统【2】;常兴实验室则基于人源AID开发了dCas9-AIDx单碱基编辑系统,用于耐药突变的筛选【3】。
所谓不依赖于DNA链断裂的基因编辑技术,实际上又可称之为单碱基基因编辑技术。事实上,自2016年4月开始,以David Liu、Akihiko Kondo以及上海交大常兴实验室为代表的好几个团队就相继在Nature、Science、Nature Methods杂志上首次报道了不同类型的单碱基基因编辑系统【1-3】。不同的是David Liu实验室基于的是胞嘧啶脱氨酶APOBEC1(能催化C脱氨基变成U,而U在DNA复制过程中会被识别成T)和尿嘧啶糖基化酶抑制剂UGI(能防止尿嘧啶糖基化酶将U糖基化引起碱基切除修复)开发了第二代和第三代单碱基编辑系统APOBEC-XTEN-dCas9-UGI (BE2)和APOBEC-XTEN-Cas9n-UGI(BE3)【1】;而Akihiko Kondo实验室则基于七鳃鳗的胞嘧啶脱氨酶PmCDA1开发了dCas9-PmCDA1-UGI和Cas9n-PmCDA1-UGI单碱基编辑系统【2】;常兴实验室则基于人源AID开发了dCas9-AIDx单碱基编辑系统,用于耐药突变的筛选【3】。
然而上述纠正单碱基突变的技术局限于只能将G•C碱基对转换成T•A 碱基对,对于将A•T碱基对转换成G•C碱基对一时还无法解决,从而限制了单基因基因编辑技术的广泛应用。这里面存在的一个长期问题是没有找到合适的腺嘌呤脱氨酶。尽管有研究表明存在具有活性的腺嘌呤脱氨酶,然而这些酶一般只针对单碱基的腺苷或腺嘌呤或者错配的RNA:DNA异聚体上才有活性,而不能在正常的DNA链上进行脱氨。那么如何才能获得合适有效的腺嘌呤脱氨酶呢?那么选择对从细菌到哺乳动物中存在的相关酶类进行改造就不失为一个好办法。
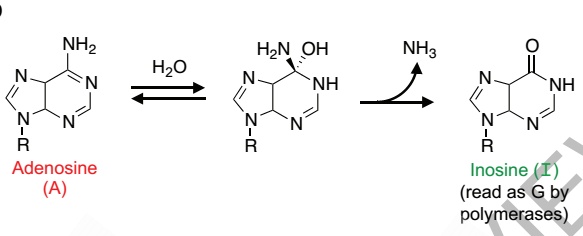
腺嘌呤脱氨酶能将腺嘌呤A转变为次黄嘌呤I,I被聚合酶识别为G
在这项研究中,David Liu实验室的研究人员通过使用蛋白进化和蛋白工程的手段通过大量的实验终于成功改造获得了能够对正常DNA上腺嘌呤脱氨的酶——E. coli TadA(ecTadA),然后将ecTadA与dCas9融合(ecTadA-dCas9)就可以进行检测了。后面的故事以及进行的优化以提高效率和准确率就不用多讲了,这都是水到渠成的事情了。
在所有已知的疾病相关单碱基对突变中,约有一半涉及野生型G•C碱基对转换成突变型A•T碱基对,因此将A•T碱基对突变回野生型的G•C碱基对就显得十分有意义了,然而此前的技术仅能将G•C碱基对变为A•T碱基对,因此过去的单碱基基因编辑技术有很大的局限性。而上述工作中的新型碱基编辑器则有可能恢复大量这一类的突变。
David Liu实验室的研究还表明,ecTadA-dCas9碱基编辑器对细菌细胞和人类细胞的DNA均有效。且在人类细胞中,它们能够在大范围的目标区域内引入预期遗传突变,效率约为50%,高于任何其它基因组编辑方法的效率,而且几乎无任何不良副作用,如随机插入、删除或其它突变等。
因此,该工具的问世将为今后大范围内治疗点突变遗传疾病提供了极大的便利。不得不说,很多事情真的是事在人为。
参考文献:
1、Komor, A.C., Kim, Y.B., Packer, M.S., Zuris, J.A. & Liu, D.R. Programmable editing of a target base in genomic DNA without double-stranded DNA cleavage. Nature 533, 420-424 (2016).
2. Nishida, K. et al. Targeted nucleotide editing using hybrid prokaryotic and vertebrate adaptive immune systems. Science 353 (2016).
3. Ma, Y. et al. Targeted AID-mediated mutagenesis (TAM) enables efficient genomic diversification in mammalian cells. Nature methods 13, 1029-1035 (2016).
 David Liu教授(图片来自其实验室网页)
David Liu教授(图片来自其实验室网页)
 David Liu实验室成员在Retreat时的合影
David Liu实验室成员在Retreat时的合影


{replyUser1} 回复 {replyUser2}:{content}