施一公:人类35%遗传病由它导致,年内要完成攻关
10月29日,2017未来科学大奖颁奖典礼暨未来论坛年会于10月28-29日在京举行。清华大学副校长、中国科学院院士、2017年未来科学大奖-生命科学奖获奖者施一公发表主题演讲。
 未来科学大奖-生命科学奖得主施一公
未来科学大奖-生命科学奖得主施一公
对于此次因对“RNA剪接体的结构及机制”的研究而获奖,施一公表示,其实从二十年前拿到普林斯顿助理教授开始就很想做剪接体的研究,而在十年前回到清华后,2007年开始在实验室布局做剪接体,通过清华大学设施购置了亚洲第一台能够工作的300千伏的电镜。
“这个不是一个意外,我和我的同事通过事先的判断意识到冷冻电镜的革命即将开始,我们可以说这是一个赌博,我们赌对了,所以当冷冻电镜产生革命的时候,清华也马上成为整个世界冷冻电镜技术开发和应用中心”,施一公介绍称,实验室利用这个平台解析了来自于酵母的第一个剪接体的结构,这也是人类第一次看到了剪接体如何工作。“其实剪接体就是一个蛋白质介导的金属RNA酶,这是第一次向人类证明这一点。”而在酵母之后,人类剪接体成了实验室的另外一个目标,施一公团队已经开始下一步的攻关过程,“三个月之前进行的人源的第一个剪接体的结构,目前我们对整个剪接体的研究进入了新阶段,我相信一年之内可以对整个人源剪接体完全搞清楚。”解析剪接体的结构和机制的意义是什么?
 施一公获奖评语
施一公获奖评语
施一公表示,目前人类35%的遗传疾病或由选在择性剪接异常所导致,比如视网膜色素变性,脊髓性肌肉萎缩症,慢性淋巴细胞性白血病等。在将人源剪接体的结构和机制研究清楚后,对于相关疾病的治疗与药物研发均有重大意义。
“去年12月,美国食品药品检验据批准的第一个针对剪接体从现象到机理到药物研发的药,这是专门针对刚才我所说的非常严重的剪接体疾病叫做SMA(脊髓性肌萎缩症),这个药非常昂贵,第一年要75万美元一个病人,从那以后每年有37万五千美元才能够把这个病控制住”,施一公说,但非常可喜的是这个药用到病人身上非常有效,病人可以到现在为止都活得比较健康。以下为施一公演讲全文:
施一公:谢谢王晓东的介绍,很高兴有今天这个机会给大家介绍一下我们实验室最近的工作。今天我给大家带来的下面三十分钟左右是给大家介绍一下在过去十年,我们实验室的主要工作之一,就是真核信使RNA方面的内容,我分四个方面介绍,先介绍X射线晶体技术的诞生和它的应用。我是一个结构生物学家,我想大家不会不熟悉从宇宙大成的结构到我们身体内每一个细胞的微观结构,都是结构,我们最终理解世界,必须理解这些机构,我们叫做眼见为实,如果医生不了解疾病、器官的结构,最后不可能下药,不可能决定手术方案,同样一个道理,我这样一个结构生物学家不了解细胞被每一个蛋白,每一个分子的空间三维结构,每一个原子在空间的定位,我一定也不会理解细胞内的生命过程是如何发生的。我就是这样来做结构,做结构生物学。
所谓结构就是通过原子分辨率结构的解析来了解生命,然后对生命的问题进行干预,比如说对于疾病的治疗,药物的发现产生深远影响。目前结构生物学最主要的手段有三个,一个是X射线,晶体衍射学,冷冻电子显微学和核磁共振,今天我给大家介绍前两个。
由于这三项技术的出现,目前在我们的丹麦结构库一直到最近为止,有138840个结构,这其中80%以上都来自于X射线晶体衍射学,这些结构的出现从根本上改变的人类对生命的认识,从根本上促进了人类对药物的发现和对健康的进一步的好转。
第一部分,X射线晶体学技术的诞生,大家知道1895年荷兰化学家伦琴发现了X射线,这个照片的右边是著名的伦琴夫人婚介手指的照片,伦琴发现了X射线的穿透能力,被用到了今天的医药检测,但是没有发现对规则蛋白质和小分子晶体具有衍射能力。对于我来讲,对于像我这样的结构科学家来讲,我们经常做的事情是把蛋白质高度乘化以后进行结晶,大家看到结晶后的蛋白质在偏光下呈现出五颜六色,包括右边的都是自然成长的蛋白晶体,和规整排列的艺术图案是一样的,微观情况下这些打败之排列的整齐,使他们对X射线具有强大的衍射能力。蛋白的衍射能力,尤其是一开始,小的离子晶体,比如说氯化钠晶体演示能力,被德国科学家发现的。伦琴发现了X射线,1961年第一个获得诺贝尔奖,而1914年又有人获得了诺贝尔奖,这个右侧是典型的蛋白的衍射图谱,显然包含了结构信息,如果找到一种办法把结构信息凸显在图谱中能够找到,能够解析出来,那么人类观测微观世界能力会得到极大的提高,这个规律是由一对英国父子科学家布拉格,有他们父子发现的,他们发现的规律是简称为布格拉公式,这个布拉格公式非常强大,不仅可以解析晶体衍射,也可以解析很多个电磁波相关的结构成像原理,根据这样一个非常简单的N波的波长这样的公式,我们可以推导出非常复杂X射线,通过蛋白晶体以后衍射成像的原理,以及从成像之后的图像解析结构。
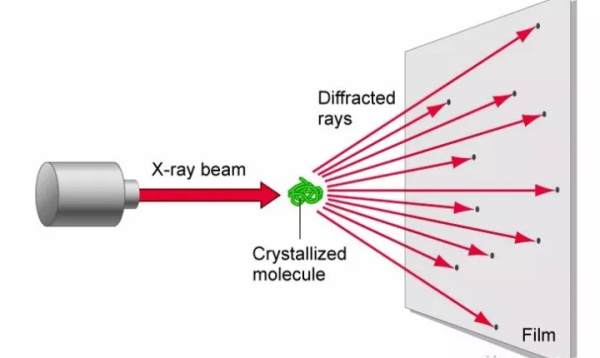 X-ray diffraction
X-ray diffraction
大家可以看到的六棱度晶体通过X射线以后会衍射出不同的光板,然后通过计算机经过分析以后告诉你什么呢,电子云密度图,每一个原子周围的电子云的形状和大小,根据形状和大小可以分子建模,把每一个原子搬到电子云里面去,大家最后看到的是一个色彩缤纷的蛋白质,这个过程让我们了解到了蛋白的精细结构,了解细胞内的生命活动。因为结构生物学的出现和X射线的发展,我们对证明过程有了质的飞跃,整个20世纪最伟大的发明之一是DNA双螺旋的发现,通过DNA纤维的X射线的衍射来发现的,这张图上的右边是著名的科学家(肉四福莱科林 音)和左侧的(杰克斯毛森 音)一起解析了第一个,或者是说推测出了第一个DNA双螺旋的结构,一出现从根本上解释了人类的遗传,是一对通过非共价键的链,分开以后成为一条遗传信息完全相同的两条链,一到二,二到四,父母到子女,遗传信息可以不断的延续下去。
60年代,这张图上左侧的(迈可森路子 音)又一起解析了个非常重要的蛋白结构,分别是肌红蛋白和血红蛋白,而肌红蛋白和血红蛋白的结构震惊了当时世界科学界,大家没有想到蛋白是不对称的,每个蛋白都有自己独特的分子功能,蛋白结构出现开始,我们整个人类所知道的生化过程开始得到一步一步的解释,现在在座的任意一位翻一本生化书会知道一半的插图来自于蛋白结构,当然蛋白结构和大分子结构,以及一些伟大的发现,诺贝尔奖在历史上对结构生物学特别的亲睐。右边那张图实际上是诺贝尔奖的计划树,大家可以看到两个分支,一个来自英国,一个是来自于美国,分别产生出十几个,几十位诺贝尔奖得主,仅仅在结构生物学这样一个非常小的领域里。
第二个我简单介绍一下冷冻电镜技术的浴火重生,因为它的产生落后于X射线学,他并没有对生命的解析做出重大的贡献,但是过去十年左右突飞猛进,所以我管它叫做浴火重生。冷冻电镜,第一台出现在1933年,大家看到的这位老先生也是1986年的诺贝尔物理学家得主,无论得奖的时间还是冷冻电镜的出现,还是生命科学的探索都远远晚于X射线晶体衍射学,它怎么看物质世界呢?大家可以看到不同的X射线投射电镜直接穿透左边可以获得二位投影,可以想到积木投在不同的图片上有不同的数字,最后把三个不同的投影三维重建积木来,同样的道理,右侧可以想象,各个蛋白分子角度都有投影的话,一个二位的投影重构成三维图像,这样一个重构过程,就是冷冻电镜的结构解析的过程。
这张图显示的冷冻电镜的整个解析过程的一个基本的示意图。账面过来的是电子束,穿过样品以后投影到下面,二维的图像通过计算机分类,把一个一个打败颗粒挑选出来,再把颗粒分类,这些颗粒分类,每一种不同的类型有一个投影,把投影放在一起合成三维图像这样一个过程。
大家可以想像这样一个投影过程很复杂,而因为电子的能量很高,在以前传统的相机,因为电子能量太高,可能会烧坏下面的(英文),不得不把电子能量进行衰减,最后才能够打到(英文)上面。这样一个衰减过程,同样是一个电子,它的电子入射打出来的图像变成了模糊的过程。所以以前的整个的电子显微镜,冷冻电子显微镜分辨率很低,常常是几纳米或者是几十安,看不到子的细节,所以我们经常说这个时候看到的图像我们叫做雪人模型,模模糊糊的,可以看到大的特征,大是看不清楚细节,2012年年底,五年前,科学家通过了工程、物理、材料等合作,创造出一个新型的监测器,在右侧,电可以直接打到检测器上,就是职业电子检测装置,这样一个装置可以让我们来一个一个的数电子打到哪,可以非常精准的把这样一个二位投影图像记录下来。这样一个技术的革命性突破,使得我们的分辨率得到大幅度的提高。
所以说这样一个方法,冷冻电镜的革命也成为2015年的(英文),这是被自然方法评选出来的。因为这个方法的突破使得现在我们对于物质结构,比如说蛋白质和生物蛋白质的结构可以突飞猛进,从以前的几十安,几纳米,突破到现在两个单位,我豪不怀疑,五年内我们会突破一个,也许十几二十年之内我们会凸显零点几个单位,我相信材料科学和物理科学的科学家在一起合作,一定会创造一个又一个大家想象不到的奇迹。
同样,非常有意思,今年诺贝尔化学奖,授予了冷冻电镜领域做出了巨大贡献的三位科学家,当然除了这三位之外,还有其他的很多科学家,做出过巨大的贡献,对整个冷冻电镜在生命科学领域的应用做出过,应该说是划时代的贡献,他们应该真的是叫实至名归的贡献,2017年。
下面我会用几分钟时间介绍一下我们从事剪接体的工作,剪接体的结构用最精细的电镜技术的产生的,大家看到左侧第一个图像是用很古老的电镜整整40年之前,1977年,一个是来自麻省理工的教授,一个是来自当前(冷全搞 音)的教授分别看到的一幅图像,说什么呢,当一个DNA病毒的单链的DNA序列和成熟的mRNA进行互补之后,发现了单链DNA会有一个一个环状的东西会出去。这样的环状DNA显然是不需要的在最后的mRNA中,也就是大家所说的内含子,这些内含子需要间接条,这些现象的发现使得他们在1993年获得了诺贝尔奖,这个发现应该说从根本上完成了大家所熟知的中心法则,什么是中心法则呢?就是我们所有生物共同遵循的信息传递法则,什么信息传递呢?大家可以想一下,我们最根本的信息是我们的遗传信息,从父母可以到子女,传宗接代,任何一种生物都是如此,你可以想象任何一个高等生物,成体的发育来自于受精卵,只有一套DNA,那么这一套DNA,一定最后会被发育成一个成体,中间的信息会不停的得到传递和复制,所以说DNA的复制是信息的一部分,就是第一个。第二个是从DNA变成执行生命功能的蛋白质,必须经过两步,其中一步叫转录,也就是把DNA成RNA,第二步从RNA翻译成蛋白质才可以执行功能,这里我能够讲话,能够运动,能够跟大家交流,能够表达思想,都是因为蛋白质在做这些活动。仅此而已。
但是,这样一个中心法则适用的范围,虽然适用于所有的生物,但是任何生物中必须得到一步重要的修整,不经过修整的法则只适用于非常低等的生物,仅止于细菌为止,这个修正的法则,来自于任何分子的DNA,经过转路之后不能把转路之后的RNA直接翻译成蛋白质,而且转录后的RNA在每两端能够具备蛋白信息的外显子之间都有一个内涵子不具备蛋白信息。需要被剪切掉,所以这个时候的RNA我们管它叫做Pre-mRNA,经过剪接才可以翻译成蛋白的MRNA,所以我们的法则,从高等生物,什么是高等生物,酿酒酵母以上的细胞都是高等生物,有细毛核的生物都是高等生物,遵循这样的法则,遗传物质从转路到前提显示,也是叫做RNA,Pre-mRNA,经过剪接成为成熟的RNA,然后经过翻译变成蛋白质。这个过程说得具体一点就是左边,大家可以看这是很形象的。我可以告诉大家这三步里边第一步和第三步都是比较简单的,你可以这样想,为什么比较简单呢?第一步从DNA到Pre-mRNA是一部线性一步完成,每一个DNA碱基对应一个RNA碱基只要能够很顺利的转路出来就是一对一的关系,而第三步,蛋白质的翻译就是从成熟的mRNA到蛋白质也是线性关系,你只需要把每三个甲基对连续的碱基变成一个氨基酸连在一起就可以了。中间你可要不出错,蛋白质自身含有的折叠信息就可以折叠成一个正常蛋白,但是中间这一步剪接非常复杂,你可以想象一下为什么?因为每一个复杂的,比较长的Pre-mRNA会有很多的外显子,每两个外显子之间都有一个黑色的内含子,这些内含子都要被准确的识别然后剪接掉,很遗憾,这些内含子的序列非常不相同,尤其是人体中间,我们的内含子经常每两个之间只有几个核苷酸的相似度,或者是十个左右的核苷酸的相似度,你要找到,再准确的剪接是一个非常复杂而困难的过程,这个过程是由剪接体来执行,剪接体是一个非常复杂的过程,大家看黑体字是左边的开始,到B一直到上面,一共有七个不同的剪接体,每两个剪接体之间的组分不一样,构像不一样,整个功能也不一样,为什么?我们就是为了有这么多不同的剪接体才能够保证剪接过程正常进行,能够把每两个外显子之间的内含子准确的进行剪接掉,这些细节我在这里不具体讲了。
大家可以想像因为剪接过程如此之复杂,你需要七个不同的剪接体,准确的识别内含子,把外显子拼在一起,这个过程很容易出错。以至于目前为止我们认为人类已知的遗传疾病里,大约35%来自于剪接遗传,我顺便说一句,我们人的基因里面,人体整个的遗传物质里面,大约每个细胞里我们都有这套遗传物质,大约两万个可以翻译成蛋白的基因。但是实际说我们人体的蛋白,不少于八万个不同的蛋白,这八万个蛋白的序列是不一样的,为什么可以两万个基因,八万个蛋白呢,因为对于很多基因来讲,我们叫做不同的剪接拼接体,我们可以把外显子去掉,也可以把另外的一些外显子,不在一起的外显子拼接在一起,显示不同的蛋白,这个过程一旦出错以后会有很严重的遗传病,比如说中间这个脊髓性肌肉萎缩症,从婴儿出生开始就非常的艰难,婴儿很难活过两岁,如果不得到及时的救治的话,是一个非常要命的遗传病。
这个剪接体的工作,其实从整整二十年之前,我拿到了普林斯顿助理教授开始就很想做,今天就不给大家讲这段故事了,真正开始做是十年之前,是回到清华以后,2007年开始在实验室布局做剪接体,这个过程中我们非常幸运,通过清华大学,通过国家的医学设施购置了亚洲第一台能够工作的300千伏的电镜,这个不是一个意外,完全是我们自己的设计,因为在清华,我和我的同事通过事先的判断意识到冷冻电镜的革命即将开始,我们可以说这是一个赌博,我们赌对了,所以当冷冻电镜产生革命的时候,清华也马上成为整个世界冷冻电镜技术开发和应用中心,我们实验室利用这样一个空间技术的平台解析了来自于酵母的第一个剪接体的结构,这三位同学,一位是实验室的博士后,就是第一个解析剪接体团队的非常优秀的攻关小组。中间的照片是37个蛋白和四个RNA分子在一起,经过非常复杂的相互作用和组装之后的大分子机器,这样一个大分子机器的出现让我们人类第一次看到了剪接体如何工作。就是这个机器代表了最后一个剪接体的状态,我们叫做(英文)。具体看到了什么呢?我告诉大家具体东西之前,希望大家看一下我们所谓的冷冻电镜密度图,它有多好,大家看到的,正在旋转的是总体的示意图,大家可以看它的情状是千奇百怪,像一个站着的人,像间接体的空间结构,右边这张图显示的是密度图,就是你能看到螺旋周围出现的侧链,能够被我们精准的构建进去。
剪接体(英文:spliceosome)是指进行RNA剪接时形成的多组分复合物,其大小为60S,主要是由小分子的核RNA和蛋白质组成。
通过冷冻电镜结构的解析,我们第一次看到了活性中间的三条小RNA如何排布,以及四个金属离子,两个用于综合RNA带负电的集团的折叠,两个用于催化反应,这个非常保守的反应中心。
随后,这是一个总结,刚才我讲了总结,随后我们根据总结意识到,其实剪接体就是一个蛋白结导的金属RNA酶,这是第一次向人类证明这一点,最后我们快马加鞭产生了,又解析了,这是剪接体的过程中形成了非常大的结构,以及我们叫做(英文),第一个剪接体组装以后的被激活剪接体的结构,以及第一个反应以后的(英文)结构,以及第一步反映之后做了调整,做了第二步反应之前的(英文)结构,然后第二个反应之后的结构,这些结构放在一起让我们对整个剪接过程有了充分的认识,我们完全复原了剪接的两步,大家看到我们所谓的电子显微镜的密度图,想告诉大家这些密度图足以告诉你金属粒子在哪,应该说原子分辨率的结构,可以看到有一些氧原子从磷上出来的状态。
这个视频是根据我们结构的解析综合之后的途径,通过动画把RNA如何执行剪接解释得清楚,大家看到第一步反应把无撇RNA送进去,然后通过第一步反应把无撇的(英文)截断,形成一个(英文)。经过结构的变化,把三撇的(英文)送进去,然后两边的外含子,外显子,联结在一起,然后从里面再出来,这个过程是由蛋白催化的,我再让大家看最后一个。这个过程根据刚才我介绍的七个原子结构,可以很精准的把每一步搞得清清楚楚,像这种情况下,像RPR2,可以看到的是能够拉RNA的一个酶。它拉了RNA之后把蛋白拉掉,然后通过序列会把RNA再放进去进行第一步第二步反应,这是第一步反应的准备,然后第一步反应需要一些小分子进去,需要小蛋白进去,稳定活性反应中心。这是第一步反应之后形成套缩结构和无撇外显子,下面进行第二步反应。用另外一个RNA霉,RNA解旋霉,通过CNA把蛋白解旋下来,然后再进行一系列的第二步反应准备。这个时候第二步反应已经准备好了。大家看进去的话,第二步反应马上进行。两个外显子,无撇和三撇,红色的,马上进行拼接,紫色的内含子套锁会被解放出来。最后一个RNA解旋霉会把这个(英文)拉出来,最后整个最后我介绍一下人员的剪接体,前面我们了解了木剪接体的整个过程,人类剪接体是另外一个目标,我们实验室的同学已经开始下一步的攻关过程,三个月之前进行的人猿的第一个剪接体的结构,目前我们对整个剪接体的研究进入了新阶段,我相信一年之内可以对整个人猿剪接体完全搞清楚,下一步面临的是在人猿剪接体搞清楚以后的机制,再进一步的研究,尤其是相关的疾病的致病机理研究做清楚,我特别想说的是剪接体的研究和药物的研发和疾病的改善有很大的关系,去年12月,美国的食品药品检验据批准的第一个针对剪接从现象到机理到药物研发的药,这是专门针对刚才我所说的非常严重的剪接体疾病叫做SMA,这个药非常昂贵,第一年要75万美元一个病人,从那以后每年有37万五千美元才能够把这个病控制住,非常可喜的是这个药一旦用到病人身上非常有效,病人可以到现在为止,从临床试验一期用药病人,还是活得比较健康的。我在想,有一天我们对人猿剪接体的解析一定会通过这样一个过程理解机理以后用于人类的制药,改善人类的健康,非常感谢大家的耐心,我今天有一点超时,这是我整个的团队,战斗在剪接体工作的第一线,感谢大家。


{replyUser1} 回复 {replyUser2}:{content}