2019年|上半年FDA批准的新剂型(1-6月)
来源:药物传递系统
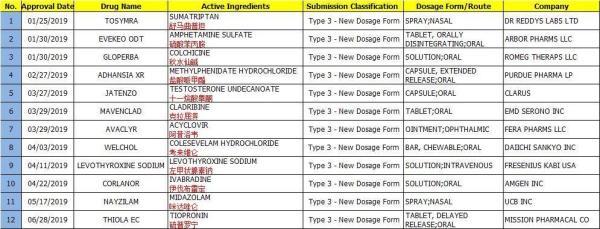
2019年上半年,FDA一共批准了12款新剂型(Type 3 - New Dosage Form)。
简介
1、Tosymra
Tosymra(舒马曲坦喷鼻剂,10mg),用于成人偏头痛(有或无先兆)的继续治疗。Tosymra是一种雾状鼻喷雾剂,作用迅速,耐受性良好,该药在美国的上市,将为该地区的偏头痛患者提供一种新的治疗选择。
Tosymra喷鼻剂采用了一种专有的新型赋形剂Intravail,以实现舒马曲坦血液水平类似于4mg舒马曲坦皮下注射剂,并实现快速起效。
2、EVEKEO ODT
Evekeo Odt为一种含有安非他明硫酸盐的口腔崩解片,适用于治疗6至17岁患有注意力缺陷多动障碍(ADHD)的青少年儿童。该药由Arbor Pharms Llc研发,于2019年1月30日获FDA批准上市。
ADHD是一个全球性的问题,国内外患病率相近,国内报道患病率为4.31%~5.83%,国外报道为3%-6%,男孩多于女孩,男女患病率之比为4~9∶1。针对ADHD治疗的首选药物是中枢兴奋剂,如哌甲酯有短效(利他林)与长效制剂(专注达、择思达)。其次还有 (丙咪嗪、舍曲林、氟伏沙明、安非他酮等) 。
3、GLOPERBA
来自ROMEG Therapeutics 的GLOPERBA® (秋水仙碱口服溶液)( 0.6 mg/5 mL )在2019年1月30日获得美国FDA批准上市,这是首款在美获批的治疗急性痛风( prophylaxis of gout flares )的口服溶液。(NDA 210942、制剂专利2036年11月到期)
秋水仙碱会对内脏产生副作用,使用秋水仙碱治疗急性痛风的医生经常需要调整剂量或中断患者治疗,以解决药物与其他治疗(例如肾透析)的相互作用。怎样调整秋水仙碱的剂量,来满足肾脏和肝脏有损伤的痛风患者的需求是一个亟需解决的难题。
ROMEG Therapeutics解决了这一难题,与市场上现有的秋水仙碱胶囊相比,该公司开发的GLOPERBA口服液可以让医生轻松调节患者的剂量。另外,美国大约有15%的老年患者吞咽困难,无法吞服固体药丸,GLOPERBA口服液可以让他们轻松服药。
4、ADHANSIA XR
Adlon制药公司近日宣布美国食品和药品监督管理局(FDA)已经批准Adhansia XR™(盐酸哌甲酯)缓释胶囊CII(一种中枢神经系统(CNS)调节剂),用于治疗六岁及以上注意缺陷多动障碍(ADHD)的患者。在AWE研究中,Adhansia XR在给药后的第1、2、5、8、11和16小时显示出相对于安慰剂的统计学显著改善。
Adlon Therapeutics总经理Marcelo Bigal博士说:“哌醋甲酯药物是某些被诊断患有ADHD的患者的首选治疗方法之一。我们很高兴FDA批准Adhansia XR,这是ADHD患者的新选择,他们可能会受益于给药后1小时和16小时的治疗效果”。
5、JATENZO
近日,生物制药公司Clarus Therapeutics宣布,公司旗下口服胶囊Jatenzo(十一酸睾酮)获FDA批准,可用于治疗男性性腺功能减退症。
Clarus Therapeutics的主打产品是一款名为Jatenzo的睾酮十一酸酯口服制剂,该药物是一种软胶囊,可以促进肠道淋巴系统的吸收,是FDA批准的首款口服睾酮药物。相比目前市面上已获批的T替代疗法,Jatenzo具有以下两点优势:一是Jatenzo提高了睾酮的生物利用度,减少了食物对药物吸收的影响;二是该药物是一种易于吞咽的软胶囊,患者使用方便。
据了解,Jatenzo有三种剂量可供选择:158毫克,198毫克和237毫克,每日两次,可以与食物一起服用。临床试验表明,在接受Jatenzo口服药治疗的男性中,有87%的男性内源性睾酮循环水平达到正常范围。该公司预计,Jatenzo将在今年年底之前在美国各大药店销售。
Jatenzo为这些患者提供了一个重要的补充治疗方案。目前,这些患者最常用的治疗方法是通过皮肤涂抹或注射睾酮药物。作为FDA批准的首款口服睾酮药物,Jatenzo将为他们带来更大的便利。
6、MAVENCLAD
德国默克(Merck KGaA)近日宣布,FDA已批准Mavenclad(cladribine,克拉屈滨片剂),用于复发缓解型多发性硬化症(RRMS)和活动性继发进展型多发性硬化症(SPMS)成人患者的治疗。Mavenclad是首个也是唯一一个获FDA批准、在2年内最多口服20天即可提供2年疗效的口服多发性硬化症(MS)药物。
MS中心联盟(CMSC)首席执行官June Halper表示,“FDA对Mavenclad的批准对于患有RRMS和活动性SPMS的人来说是个大好消息。Mavenclad提供了一个新的、有效的治疗选择,具有不同于目前任何其他药物的口服给药方案,不输注、不注射,一年服药不超过10天。Mavenclad将成为MS患者群体中的一种受欢迎的口服疗法。CMSC祝贺默克公司将Mavenclad作为第一个短程口服治疗选择带到美国。”
7、AVACLYR
2019年4月1日,美国食品药品监督管理局(FDA)批准Fera新药Avaclyr 3%(阿昔洛韦眼用软膏),用于治疗疱疹性角膜炎,同时授予7年孤儿药专卖权。
Avaclyr(阿昔洛韦眼用软膏)3%,是单纯疱疹病毒核苷类似物DNA聚合酶抑制剂,用于治疗单纯疱疹病毒(HSV-1和HSV-2)病毒的急性疱疹病毒性角膜炎(树突状溃疡)。患者报告的最常见不良反应(2-10%)为眼痛(刺痛),点状角膜炎和滤泡性结膜炎。
8、NAYZILAM
比利时药企优时比(UCB)近日宣布,美国FDA已批准其最新抗癫痫药物(AED)Nayzilam(midazolam)鼻喷雾剂CIV。这是一种经鼻腔给药的苯二氮卓类药物,适用于12岁及以上癫痫患者,用于频繁发作活动(如癫痫丛集发作、急性反复发作)间歇性、刻板性发作的紧急治疗。
Nayzilam是一种短效药物,通过鼻腔喷雾治疗癫痫丛集发作,该药旨在作为便于患者携带的一次性疗法,可由非医疗专业人员在患者发生癫痫丛集发作时给药治疗。
Nayzilam是FDA批准的首个也是唯一一个通过鼻腔给药治疗癫痫丛集发作的疗法,也是美国市场20多年来批准治疗癫痫丛集发作的首个新药,其鼻腔喷雾给药方式可为目前治疗选择有限的患者及其照料者提供一种新的解决方案。
9、THIOLA EC
Retrophin公司近日宣布,美国食品和药物管理局(FDA)已批准Thiola EC(tiopronin,硫普罗宁)100mg和300mg片剂,这是一种新的肠溶制剂Thiola,用于治疗胱氨酸尿症。这是一种罕见的遗传性疾病,可导致尿中胱氨酸水平升高,导致反复出现的胱氨酸肾结石的形成。
用药方面,Thiola在成人患者中的推荐初始剂量为每天800毫克,在临床研究中,平均剂量约1000毫克,即每天10片。原Thiola 100mg片剂,推荐在饭前至少1小时或饭后2小时服用。Thiola EC 100mg和300mg片剂则可与食物一起或不一起服用。
对于某些患者来说,每天三次饭前一小时或饭后两小时给药的挑战,加上药片负担很重,一直是一个挑战。有了Thiola EC这个新的治疗方案,无论食用或不食用食物都能灵活地给药,同时给病人提供减少服用药片数量的机会,这将有意义地提高给药便利性和治疗依从性。
参考信息
1.https://med.sina.com/article_detail_103_1_60149.html
2.http://www.sohu.com/a/298505266_120054371
3.https://www.xianjichina.com/special/detail_386694.html
4.http://www.medsci.cn/article/show_article.do?id=2e87161550a1
5.https://vcbeat.top/MDBlMWI5MDg5MWEwY2VlYTQwYzQyZTliNzQ5NTJhZjI=
6.https://www.haoeyou.com/qita/20190403/2499.html
7.http://www.bioon.com/article/6736052.html
8.https://med.sina.com/article_detail_100_2_66133.html
9.http://pharm.cmt.com.cn/detail/1384340.html


{replyUser1} 回复 {replyUser2}:{content}