Nat. Chem.:仿生合成Stephacidin A同系物单体及二聚体
许多药物分子,究其本源都来自于陆地和海洋生物的次级代谢产物。相比于海洋生物,陆地生物的次级代谢产物在收集采样时更加方便,因而在早期的天然产物分离研究中占据主导地位。但随着科学技术的发展,海洋生物次级代谢产物的收集、分离技术日益完善,该类天然产物也逐步得到研究者的密切关注,次级代谢产物的数量及种类迅速增加,由此而来的新药也呈猛增之势。不过,这些代谢产物往往不易分离,药物发现所需的大量样品还需要依靠化学合成。在目前发展的大量合成反应中,生源合成与化学合成两类方法相辅相成。一方面,生源合成可以为化学合成提供重要的合成思路,化学合成反过来又可以为深入探究次级代谢产物的生源合成过程奠定基础。本文便通过化学合成Stephacidin A相关的吲哚类次级代谢产物来具体阐明生源合成与化学合成的重要联系。
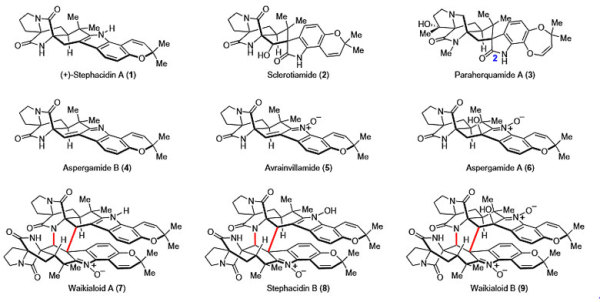
Stephacidin A(1)及其同系物都是具有独特化学结构的次级代谢产物。这类化合物可通过特定的生源合成方法将异戊二烯基或反异戊二烯基引入二氮杂双环[2.2.2]辛烷骨架、色烯及其残基单元中。
最近,美国加州大学伯克利分校(UC Berkeley)化学系的Richmond Sarpong教授设计了一条简短的反异戊二烯基吲哚生物碱Stephacidin A及其同系物的全合成路线,其关键在于对相关的天然产物中吲哚6位的直接卤化。该策略受到生源合成的启发,可以指导malbrancheamides B/C、notoamides F/I/R、aspergamide B以及二聚体waikialoid A等天然产物的全合成,由此实现了异戊二烯基及反异戊二烯基吲哚生物碱同系物的高效合成,与此同时为那些尚未确定生源合成途径的同系物的产生提供了线索。相关工作发表在Nature Chemistry 上。
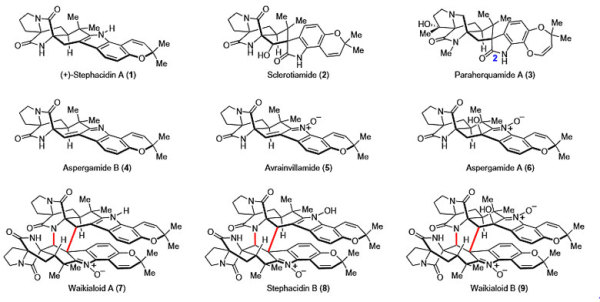
反异戊二烯基吲哚生物碱的天然产物。图片来源:Nat. Chem.
在代表性的反异戊二烯基吲哚生物碱分子中(图1),结构都包含异戊二烯基或反异戊二烯基、二氮杂双环[2.2.2]辛烷骨架、色烯单元。其中1-6为单体,7-9三个天然产物为单体的自身二聚体或者交叉二聚体。这些天然产物都表现出不同程度的生物活性,比如Stephacidin A对多种肿瘤细胞具有细胞毒性(对LNCaP细胞的IC50为1.0 μM),Sclerotiamide(2)对新型抗生素的开发具有重要的指导意义。

Richmond Sarpong教授。图片来源:UC Berkeley
Stephacidin A及其同系物的生源合成假说如图2所示。二氮杂双环[2.2.2]辛烷骨架可通过中间体10的分子内环加成过程实现,化合物10中的六元环状内酰胺异构化成双烯体,与吲哚2位的反异戊烯基中的烯烃发生[4+2]环加成就可以得到Stephacidin A,如果反异戊烯基中的单键旋转后再发生[4+2]环加成反应则得到Stephacidin A的差向异构体6-epi-Stephacidin A。其同系物Stephacidin B可通过avrainvillamide的二聚形成,两分子avrainvillamide经串联的Michael加成反应形成自身二聚体并构建新的五元环。基于以上推断,作者设想交叉二聚体Aspergamide B、avrainvillamide衍生物Waikialoid A等天然产物可能通过相似的途径完成生源合成,并由此设计以Stephacidin A作为前体,相继完成其他同系物天然产物分子的合成。尽管Stephacidin A的全合成已有报道,但以往发展的方法合成效率较低,无法提供足够的Stephacidin A样品用于后续研究,因而首先发展一种高效的方法合成Stephacidin A便成为他们需要解决的问题。
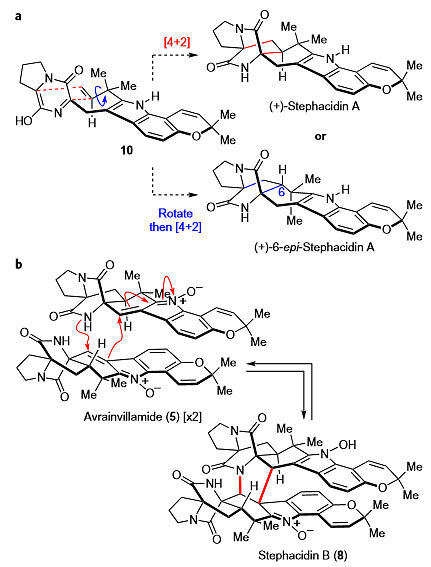
Stephacidin A及其同系物的生源合成假说。图片来源:Nat. Chem.
Stephacidin A的逆合成分析如下,以往在合成该分子的初期便完成色烯单元的构建,作者认为将该过程安排在后期可以简化合成步骤。他们从中间体11出发,C6位选择性官能团化可以引入吡喃环,从而实现Stephacidin A的合成,而11则可以通过脯氨酸12和吲哚羧酸13缩合而成。对于其他同系物的合成,11和NBS在氯仿中室温条件下反应先得到溴化物中间体14,加热至70 ℃异构化为C6位溴代的化合物15,DIBAL-H选择性还原其中一个内酰胺得到天然产物Malbrancheamide C (16),16再在光照条件下和B2(pin)2发生硼化反应,进而与水合氯化铜作用发生氯代,从而实现氯代天然产物Malbrancheamide B (17)的合成。
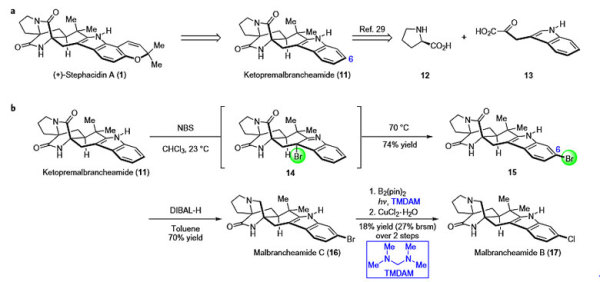
Stephacidin A的逆合成分析及Malbrancheamide C与B的合成。图片来源:Nat. Chem.
作者以11作为原料,首先通过NIS试剂使吲哚的C6位发生碘代,得到中间体18,硼化后使用双氧水处理得到酚类化合物19,19在碱性条件下对炔丙基氯化物发生亲核取代反应得到20,最终在高温条件下发生分子内环化就得到天然产物Stephacidin A。他们进一步从Stephacidin A出发,在含水的乙酸乙酯溶剂中与120当量的二氧化锰反应,吲哚的苄位氧化为羰基得到Notoamide I,而在干燥的乙酸乙酯溶剂中与30当量的二氧化锰反应,则得到Aspergamide B。随后他们从Aspergamide B出发,在三氟乙酸的酸性条件下与甲醇发生加成可以得到吲哚苄位甲氧基取代的天然产物Notoamide F,而发生水合则可以得到吲哚苄位羟基化的产物Notoamide R,Notoamide R使用Davis试剂处理可得到螺环天然产物Sclerotiamide。
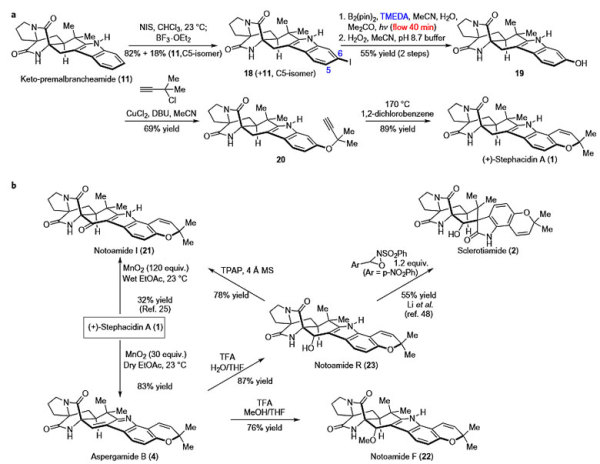 Stephacidin A及其同系物单体的合成。图片来源:Nat. Chem.
Stephacidin A及其同系物单体的合成。图片来源:Nat. Chem.
对于二聚体天然产物的合成,作者从Aspergamide B出发,经两次Michael加成反应自身二聚得到Aspergamide B二聚体,并通过X射线单晶衍射确定了其结构和立体化学;而从Avrainvillamide出发,经两次Michael加成反应自身二聚可以得到Stephacidin B。Aspergamide B和Avrainvillamide交叉二聚则得到Waikialoid A。作者还根据以上反应过程推测新分离的天然产物Versicoamide G和Versicoamide H可能分别通过Aspergamide B及Avrainvillamide和曲酸反应得到。
二聚体天然产物的合成。图片来源:Nat. Chem.
Richmond Sarpong教授课题组利用化学合成的方法实现了Stephacidin A及其一系列反异戊二烯基吲哚生物碱同系物的高效合成。与此同时,这一合成手段为确定其他Stephacidin A结构相关的次级代谢产物的生源合成途径奠定了基础。该工作对于天然产物的多样性合成以及验证生源合成假说都具有重要的指导意义。
参考材料:
Bioinspired chemical synthesis of monomeric and dimeric stephacidin A congeners
Nat. Chem., 2017, DOI: 10.1038/nchem.2862


{replyUser1} 回复 {replyUser2}:{content}