Nature:老了就生病,可能是体内“老不死的”细胞在作怪
为了延缓衰老,古有求仙问道,炼丹服药,今有基因编辑,换血养生。长生不老目前还是太遥远的一件事情,或许需要人类再花上几十年、几百年去研究,甚至也可能根本就是一场镜花水月。
所以比起这些,我们更关注如何才能健康地、有尊严地老去。想到老了之后骨关节炎可能会找上门,行动不再自如了;阿尔茨海默病可能会找上门,记性不好了,生活不能自理了;心脏病也可能会找上门,体力活干不了,累一点儿就好久缓不过来了,大家心里都在害怕。
为了能让大家老得健康、老得有尊严,大批科学家一直在努力着,其中,梅奥诊所的Jan van Deursen教授可以算是一个领军人物。现在他和他的团队已经开发了一类名为“senolytics”的药物,能够有针对性地清除体内导致上述老年病的衰老细胞,延缓疾病的发生或者减轻疾病的症状。目前,他们在动物模型中已经进行了充分的研究,很快就要开展临床试验了,《自然》杂志为他们撰写了一篇长篇新闻报道。

Jan van Deursen教授
2000年时,Deursen教授正在进行一项关于癌症的研究,这是他此前一直专注研究的领域,可是有件事让他百思不得其解,他和团队像往常一样对实验小鼠进行了基因改造,“方便”它们患上癌症,好进行研究。可没想到的是,这些小鼠没有患癌症,反而得了“怪病”,它们从3个月开始就出现了早衰现象,毛发开始变得稀疏,皮下脂肪也减少了,眼睛还出现了白内障等等。
科学家的好奇心困扰了Deursen教授很久,他开始寻找起了这些小鼠早衰的原因,没想到这一找就是8年,在2008年,他终于发现了,原来这种基因改造小鼠的体内与细胞衰老有关的两个关键基因的表达增加了。其中的一个基因,p16Ink4a,可以促进细胞的衰老。
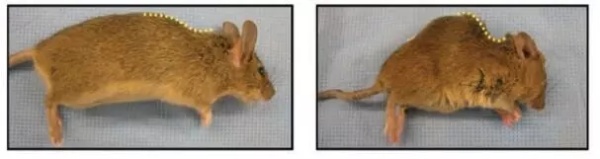
左为5月龄正常小鼠,右为5月龄早衰小鼠
五十多年前,科学家就发现衰老了的细胞(senescent cells)会停止自我复制和分裂,但是它们又不肯乖乖去死,只是像 “僵尸”一样不断分泌一些蛋白质,抵御死亡的到来。
早期的研究认为,这是细胞在面对某些压力,尤其是基因组损伤时,做出的应激反应。停止分裂就可以阻止受损或无功能细胞的增殖,从而防止肿瘤的发生。而在Deursen教授找到小鼠早衰原因的同年,有三个研究团队发现,过多衰老细胞的积累需要得到重视,因为它们分泌的一些细胞因子、生长因子和蛋白酶会影响邻近的细胞,引发局部炎症对机体造成伤害。
对于年轻的、健康的组织和机体来说,这些分泌的物质会引起免疫系统的“注意”,被消灭掉。但是,随着年龄的增长,衰老细胞会在体内逐渐积累,而免疫细胞不再能够识别并清除它们,这与骨关节炎等年龄相关疾病的发生都有关系。

科学家们已经发现,衰老细胞广泛存在于人、灵长类动物和啮齿类动物的组织中,并且在人类的年龄相关疾病,如骨关节炎、肺纤维化、动脉粥样硬化和阿尔兹海默病患者的组织中都发现了衰老细胞。
Deursen教授猜想,如果能够把这种体内的衰老细胞清除掉,或许就可以延缓衰老了吧。
为了验证这个想法,2011年,他与另一位从事抗衰老研究的同事,James Kirkland教授合作,通过一种药物,清除了表达p16Ink4a基因的衰老细胞。他们发现,在小鼠生命早期,清除衰老细胞可以延缓小鼠衰老症状的发生。另外,即使是小鼠已经发生了衰老症状,及时清除衰老细胞,也能一定程度上逆转小鼠的衰老症状。他们的研究结果刊登在《自然》杂志上。

James Kirkland教授
可以逆转衰老?这可真是了不得,依据这个惊天大发现,Deursen教授和Kirkland教授兴冲冲地向美国国立卫生研究院(NIH)递交了研究经费申请,以探究清除正常小鼠体内的衰老细胞,是否也可以达到延缓衰老的效果。
然而,这项申请却没有通过NIH专家小组的评审,NIH给出的解释是,由于经费有限,这项研究太过于创新,风险太大,因此不能给予支持。
真是应了那就话,“上帝为你关上一扇门,也一定会为你打开一扇窗”。正当Deursen教授因为没能获得NIH资助而一筹莫展时,一个名叫Nathaniel David的企业家已经在来找他合作的路上了。

Nathaniel David
Nathaniel David是加州大学伯克利分校的细胞和分子生物学博士。在和Deursen教授“擦出火花”之前,就已经成立了5家公司,包括3家生物技术公司和2家能源公司。
在一次3小时的飞行途中,David读到了Deursen教授新发表的论文,读过一遍后,他觉得意犹未尽,又读了两遍,等到飞机一落地,David就拨通了Deursen教授的电话,并在72小时之内就说服了Deursen教授来面谈组建一家抗衰老公司的事宜,在David看来,Deursen教授这个清除衰老细胞来延缓衰老的想法非常有趣。
David之所以要这么迅速组建一家抗衰老公司,除了赞赏并坚信这一发现的创新性外,还是有一点“私心的”。
因为他的父亲在十几岁时便患有早发性骨关节炎,这也是一种早衰性疾病,老人家当时已经瘫痪在床,动弹不得了。受遗传的影响,David本身也出现了退行性椎间盘疾病的早期症状。倘若他们能研发出抗衰老的药物来,那么David就不用忍受像父亲那样的痛苦了。
接下来,David又邀请了另一名抗衰老领域的专家,巴克老龄化问题研究所的Judith Campisi教授,她同时也是2008年发现了积累的衰老细胞可以引发炎症的三个团队其中一个的领导者。连同Deursen教授,三人一起在旧金山成立了一家名为“Unity Biotechnology”的抗衰老公司。

Judith Campisi教授
再后来,几位科学家就开始了“攻坚之路”,由于之前发现不同组织中的衰老细胞也略有不同,它们分泌的细胞因子,表达的细胞外蛋白和抵御死亡的途径都有差异。因此,可能每种药物只能对特定衰老细胞起效,针对不同的老年病,就可能需要多种类型的药物,这也是为什么我们在开始的时候把senolytics称作“一类药物”。
2015年,Kirkland教授找到了第一种清除衰老细胞的“senolytics”药物,即FDA批准的用于癌症治疗的达沙替尼,达沙替尼能有效清除衰老的人脂肪细胞。另外,一种从植物中提取的化合物——槲皮素可以清除衰老的内皮细胞。给早衰的小鼠定期使用达沙替尼和槲皮素治疗,清除衰老细胞,可以延长小鼠的无病寿命(healthspan),延缓一些与年龄有关疾病症状的发生,如运动能力减退。
2016年2月,Deursen教授又在《Nature》杂志上发表研究,这次的研究也很厉害,通过清除衰老细胞,他们将正常衰老小鼠的平均寿命延长了1/4左右(17%-35%)!而且还减缓了与衰老相关的器官退化,如肾脏和心脏等,且无明显副作用。
同年的8月,Deursen教授又和Campisi教授合作,在另一个权威期刊,《科学》上发表研究,采用 “senolytics”药物,清除小鼠体内的衰老细胞,对于处于动脉粥样硬化早期的小鼠来说,能够完全清除它的早期病变,而即使是晚期,也可以大大减少粥样硬化斑块。
今年,他们寻找新突破的脚步依然没有停下,在骨关节和骨质疏松小鼠模型中,“senolytics”药物清除了衰老细胞,阻止、甚至是逆转了疾病,为新的软骨细胞生成提供了条件,研究分别于4月和9月发表在《自然医学》杂志上。另外一项有Campisi教授参与的,发表在《Cell》杂志上的研究则显示,使用一种肽清除衰老细胞后,小鼠的肾功能得到提高,毛发恢复了年轻光泽。
“senolytics”药物清除衰老细胞
截至目前,科学家们已经找到了14种“senolytics”药物,包括小分子、抗体和多肽等。Unity Biotechnology已经建立了大型档案,详细记录着哪种衰老细胞对应哪种疾病,哪种药物又能清除哪种衰老细胞等信息。
值得一提的是,治疗衰老相关疾病没必要杀死组织中的所有衰老细胞。小鼠研究表明,杀死大部分细胞就足以产生差异。因此,只需将衰老细胞定期清除,比如一年一次即可。这就表示,“senolytics”药物的用药期比较短,“打完就跑”的治疗策略可以避免许多副作用。
此外,“senolytics”药物只会影响已经存在的衰老细胞,不会干涉这类细胞的形成,这就意味着衰老细胞最初的肿瘤抑制功能仍可保留。
当然,“senolytics”药物真正能用于人类抗衰老还有很长的路要走,正如Deursen教授所说:“解决衰老之谜是人类永恒的话题,只有真正了解老的真实样貌,我们才能以一种明智的方式干预衰老。”
参考资料:
https://www.nature.com/news/to-stay-young-kill-zombie-cells-1.22872
Baker D J, Jeganathan K B, Cameron J D, et al. BubR1 insufficiency causes early onset of aging-associated phenotypes and infertility in mice[J]. Nature genetics, 2004, 36(7): 744-749.
Baker D J, Perez-Terzic C, Jin F, et al. Opposing roles for p16Ink4a and p19Arf in senescence and ageing caused by BubR1 insufficiency[J]. Nature cell biology, 2008, 10(7): 825-836.
Coppé J P, Patil C K, Rodier F, et al. Senescence-associated secretory phenotypes reveal cell-nonautonomous functions of oncogenic RAS and the p53 tumor suppressor[J]. PLoS biology, 2008, 6(12): e301.
Kuilman T, Michaloglou C, Vredeveld L C W, et al. Oncogene-induced senescence relayed by an interleukin-dependent inflammatory network[J]. Cell, 2008, 133(6): 1019-1031.
Acosta J C, O'Loghlen A, Banito A, et al. Chemokine signaling via the CXCR2 receptor reinforces senescence[J]. Cell, 2008, 133(6): 1006-1018.
Van Deursen J M. The role of senescent cells in ageing[J]. Nature, 2014, 509(7501): 439-446.
Baker D J, Wijshake T, Tchkonia T, et al. Clearance of p16Ink4a-positive senescent cells delays ageing-associated disorders[J]. Nature, 2011, 479(7372): 232-236.
http://www.nytimes.com/2011/11/22/science/research-on-senescent-cells-is-denied-nih-grant.html
https://qz.com/878446/unity-biotechnology-cure-for-aging/
Zhu Y, Tchkonia T, Pirtskhalava T, et al. The Achilles’ heel of senescent cells: from transcriptome to senolytic drugs[J]. Aging cell, 2015, 14(4): 644-658.
Baker D J, Childs B G, Durik M, et al. Naturally occurring p16Ink4a-positive cells shorten healthy lifespan[J]. Nature, 2016, 530(7589): 184-189.
Childs, B.G., et al., Senescent intimal foam cells are deleterious at all stages of atherosclerosis. Science, 2016. 354(6311): p. 472-477.
Jeon O H, Kim C, Laberge R M, et al. Local clearance of senescent cells attenuates the development of post-traumatic osteoarthritis and creates a pro-regenerative environment[J]. Nature Medicine, 2017, 23(6): 775-781.
Farr J N, Xu M, Weivoda M M, et al. Targeting cellular senescence prevents age-related bone loss in mice[J]. Nature Medicine, 2017, 23(9): 1072-1079.
[16] Baar M P, Brandt R M C, Putavet D A, et al. Targeted apoptosis of senescent cells restores tissue homeostasis in response to chemotoxicity and aging[J]. Cell, 2017, 169(1): 132-147. e16.


{replyUser1} 回复 {replyUser2}:{content}