华人科学家发现Treg细胞死后仍可抑制T细胞,解开困扰免疫界十年悖论
近日,著名华人科学家、美国密歇根大学终身教授邹伟平,在《自然免疫》杂志上刊登的研究论文[1]显示:肿瘤微环境中,有一种叫做调节性T(Treg)细胞的免疫细胞,就像是“恐怖分子”。
Treg细胞活着的时候,就会抑制抗肿瘤免疫。而面对肿瘤微环境的低氧胁迫,Treg细胞经不住考验,不得不走向自杀(术语叫做凋亡),并且还会将能量载体ATP转化成一种叫做腺苷的小分子物质,特异性地作用于具有抗肿瘤功能的T细胞,抑制T细胞的活性,进而展现出比活着的时候还要强大的免疫抑制功能!
这项研究不仅解释了旨在消除Treg细胞的抗肿瘤治疗临床试验为何会失败,还解释了抗肿瘤免疫治疗为何仅对部分患者有效。此外,找到阻止或控制Treg细胞免疫抑制作用的方法,将会让更多的癌症患者从免疫治疗中受益。
 邹伟平教授
邹伟平教授
就像多数恐怖分子并非天生“穷凶极恶”一样,Treg细胞原本也是免疫系统中的“好人”,它更像是制动系统,它的存在,就是为了抑制T细胞对自身抗原的免疫应答,防止过度的免疫反应对机体造成不必要的损伤。但是,在肿瘤微环境中,面对低氧的恶劣环境,Treg细胞“叛变”了,它们不光会促进肿瘤生长还会阻碍肿瘤的免疫治疗。
早在2004年,邹伟平教授和另一位免疫界大佬,陈列平教授发现,卵巢癌患者的肿瘤细胞和肿瘤微环境中的巨噬细胞会释放一种趋化因子,召集大量的Treg细胞进入肿瘤中,而这些Treg细胞抑制了针对肿瘤抗原的T细胞免疫,这就导致了肿瘤的生长。也就是说Treg细胞成了肿瘤生长的帮凶。此外,他们还发现肿瘤中的Treg细胞与患者高死亡风险和低生存率有关[2]。
邹教授认为阻断Treg细胞的迁移或者减弱它的功能应该有助于癌症的治疗。然而,虽然在体外试验中抑制Treg细胞的活性确实能够提高T细胞的免疫功能,但是在实际的临床试验中,当给癌症患者采用消除Treg细胞的方法进行治疗时,患者的病情并没有得到改善[3]。
 这似乎有悖于常理,按说把制动系统给移除了,没有了阻挡,T细胞的抗肿瘤效果应该更强才对啊,但是事实却证明这行不通。那么,Treg细胞在肿瘤中到底搞了什么鬼?邹教授决定带领团队探究其中的奥秘。
这似乎有悖于常理,按说把制动系统给移除了,没有了阻挡,T细胞的抗肿瘤效果应该更强才对啊,但是事实却证明这行不通。那么,Treg细胞在肿瘤中到底搞了什么鬼?邹教授决定带领团队探究其中的奥秘。
研究人员首先对肿瘤中Treg细胞的状态进行了研究。他们发现在人卵巢癌肿瘤组织以及小鼠卵巢癌、结肠癌和黑色素瘤模型中,Treg细胞表现出高度的凋亡状态。并且这种凋亡是由于在肿瘤微环境中的低氧状态下,Treg细胞的抗氧化系统减弱,而对活性氧的敏感性增加造成的。也就是说肿瘤中的低氧环境导致氧化应激增强,进而促进了Treg细胞的凋亡。
那么问题来了,如果 Treg细胞“自杀”了, “制动系统”失灵了,T细胞的抗肿瘤功能应该“根本停不下来”,功能应该增强才是啊,那为何实际的免疫治疗得到的却是相反的结果呢?难道这些凋亡的Treg细胞还会继续发挥抑制作用吗?
接下来的研究结果让研究人员很是吃惊:不论是在体内还是体外试验中,凋亡的Treg细胞比活着的Treg细胞免疫抑制功能都更强大!
它在抑制T细胞产生IL-2(一种促进T细胞增殖的细胞因子)、IFN-γ和TNF(T细胞释放的“杀敌武器”)方面效果更好!此外,凋亡的Treg细胞还抑制了结肠癌小鼠自发及PD- L1抑制剂介导的抗肿瘤T细胞免疫,促进了肿瘤的增长。
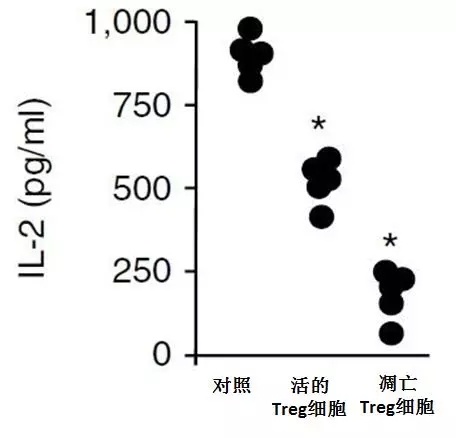 凋亡Treg细胞比活着的Treg细胞对IL-2的抑制作用更强
凋亡Treg细胞比活着的Treg细胞对IL-2的抑制作用更强
那么,凋亡的Treg细胞究竟是靠啥来引发一系列的“自杀式炸弹袭击”的呢?
研究人员在排除了巨噬细胞、PD-1、PD-L1、CTLA-4等膜分子以及一些细胞因子的影响后,发现在凋亡Treg细胞释放的可溶性物质中,分子量<3kDa的成分能够抑制T细胞产生IL-2,而分子量>3kDa的成分却不能抑制T细胞产生IL-2。这就意味着能够让凋亡Treg细胞产生强大免疫抑制作用的物质会是一种小分子物质。
可是,这种物质究竟会是什么呢?研究似乎遇到了瓶颈。
这时,经验丰富的邹教授想到了Treg细胞的一个很重要的特点,那就是它的表面带有两种可以将能量载体三磷酸腺苷降解成腺苷的酶,CD39和CD73。
在这两种酶的作用下,三磷酸腺苷最终会被降解成一种叫做腺苷的小分子物质。而腺苷则会通过T细胞表面的腺苷受体A2A来抑制T细胞的功能[4,5]。邹教授猜想,这种小分子物质或许会是腺苷。
于是,按照邹教授的思路,研究人员进行了验证,他们发现,当采用腺苷受体A2A抑制剂后,凋亡Treg细胞的抑制功能被抵消了。进一步的研究发现,凋亡Treg细胞会释放大量的三磷酸腺苷,在CD39和CD73的作用下,降解成为腺苷,并通过T细胞上的A2A受体,发挥免疫抑制功能。也就是说,凋亡Treg细胞确实是通过腺苷及腺苷受体通路发挥免疫抑制作用的。
研究到这里,可以说Treg细胞开启“自杀式炸弹袭击”的方式就很清楚了:首先是肿瘤细胞及肿瘤中的巨噬细胞通过趋化因子,引诱大量的Treg细胞进入到肿瘤组织中,成为“后备力量”。之后在低氧环境的刺激下,大量的Treg细胞开启“自杀”模式,并通过CD39和CD73将ATP转化成腺苷这种炸弹,专门作用在抗肿瘤的T细胞上,让T细胞发挥不了功能。
因此,即使是采用PD-L1抑制剂来增强T细胞的功能,也抵挡不住腺苷的 “狂轰滥炸”,这也就解释了为何只有少数癌症患者能从免疫治疗获益。
目前,邹教授团队正在研究通过创建一个路障来阻止Tregs细胞迁移到肿瘤微环境中,他们也将继续寻找阻止或控制这一免疫抑制的解决方法,让更多的癌症患者能够获益于免疫治疗。
参考文献:
[1] Maj T, Wang W, Crespo J, et al. Oxidative stress controls regulatory T cell apoptosis and suppressor activity and PD-L1-blockade resistance in tumor[J]. Nature Immunology, 2017.
[2] Curiel T J, Coukos G, Zou L, et al. Specific recruitment of regulatory T cells in ovarian carcinoma fosters immune privilege and predicts reduced survival[J]. Nature medicine, 2004, 10(9): 942-949.
[3] Attia P, Maker A V, Haworth L R, et al. Inability of a fusion protein of IL-2 and diphtheria toxin (Denileukin Diftitox, DAB389IL-2, ONTAK) to eliminate regulatory T lymphocytes in patients with melanoma[J]. Journal of immunotherapy (Hagerstown, Md.: 1997), 2005, 28(6): 582.
[4] Deaglio S, Dwyer K M, Gao W, et al. Adenosine generation catalyzed by CD39 and CD73 expressed on regulatory T cells mediates immune suppression[J]. Journal of Experimental Medicine, 2007, 204(6): 1257-1265.
[5] Kryczek I, Banerjee M, Cheng P, et al. Phenotype, distribution, generation, and functional and clinical relevance of Th17 cells in the human tumor environments[J]. Blood, 2009, 114(6): 1141-1149.


{replyUser1} 回复 {replyUser2}:{content}