Nature子刊:姜汤或可治疗和预防2型糖尿病以及肥胖
近日,来自加州大学旧金山分校糖尿病研究中心的Shingo Kajimura博士带领的研究团队《自然医学》杂志上发表了一项最新研究,他们发现了哺乳动物调节体温以及机体血糖平衡的另一重要途径。
哺乳动物米色脂肪细胞中存在一种名为SERCA2b的蛋白质,这种蛋白质被激活后可以显著增强米色脂肪细胞的糖酵解以及线粒体有氧呼吸功能,加速对葡萄糖和脂肪酸的摄取和分解,释放大量热量,更为关键的是,还显著增强了机体对于胰岛素的敏感性!
有趣的是,生姜中的姜酚就可以激活这种SERCA蛋白。之前也已有研究表明,生姜中的姜酚通过激活SERCA蛋白,可以改善糖尿病诱发的小鼠心肌收缩障碍(2)。
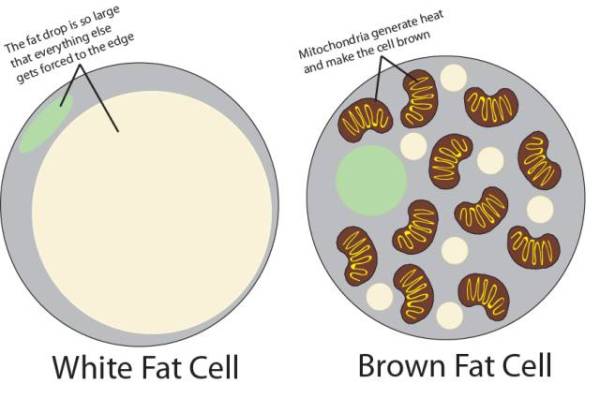
 哺乳动物的脂肪组织主要分为两类。一是白色脂肪组织,主要分布在皮下、网膜和肠系膜等处,是机体最大的“能量库”,具有储存脂肪、保持体温和参与脂肪代谢功能。二是棕色脂肪组织,这种脂肪组织中含有大量的线粒体,在寒冷刺激下这种脂肪组织可以分解脂肪产生大量的热能,不过这种脂肪组织主要存在于新生儿体内。
哺乳动物的脂肪组织主要分为两类。一是白色脂肪组织,主要分布在皮下、网膜和肠系膜等处,是机体最大的“能量库”,具有储存脂肪、保持体温和参与脂肪代谢功能。二是棕色脂肪组织,这种脂肪组织中含有大量的线粒体,在寒冷刺激下这种脂肪组织可以分解脂肪产生大量的热能,不过这种脂肪组织主要存在于新生儿体内。
而在1992年的时候,Cousin等发现,如果将啮齿类动物长期暴露在寒冷环境中,可以在它们的皮下白色脂肪组织发现棕色脂肪样细胞,而没有外界刺激时,原来白色脂肪细胞中不会出现棕色脂肪细胞。不过当时人们并不清楚其中的原因(4)。
 直到2008年,Seale等发现哺乳动物白色脂肪组织中存在一种特殊类型的脂肪细胞,这种细胞正常情况下与白色脂肪细胞类似,而寒冷等外界条件可以刺激发生转化,变得与棕色脂肪细胞类似,具有强大的产热功能。他们将这种细胞称为米色脂肪细胞。同时,研究人员还确定,这些细胞主要分布于皮下白色脂肪组织中(5)。
直到2008年,Seale等发现哺乳动物白色脂肪组织中存在一种特殊类型的脂肪细胞,这种细胞正常情况下与白色脂肪细胞类似,而寒冷等外界条件可以刺激发生转化,变得与棕色脂肪细胞类似,具有强大的产热功能。他们将这种细胞称为米色脂肪细胞。同时,研究人员还确定,这些细胞主要分布于皮下白色脂肪组织中(5)。
由于米色脂肪细胞本身只包含少量的线粒体,因此不具有棕色脂肪细胞那样强大的燃烧脂肪产热的功能,因此,有学者认为米色脂肪细胞在整个机体的能量代谢中并没有太大的作用(6)。
 然而,另外一些学者在对米色脂肪细胞的研究过程中发现,通过遗传学手段或者药物的方式诱导米色脂肪细胞的大量产生,可以增加机体的能量代谢,同时显著增强小鼠对于肥胖以及葡萄糖的耐受性(7,8)。同样地,仅使用遗传学手段消除小鼠体内的米色脂肪细胞就足以诱发小鼠的肥胖以及糖尿病(9)。
然而,另外一些学者在对米色脂肪细胞的研究过程中发现,通过遗传学手段或者药物的方式诱导米色脂肪细胞的大量产生,可以增加机体的能量代谢,同时显著增强小鼠对于肥胖以及葡萄糖的耐受性(7,8)。同样地,仅使用遗传学手段消除小鼠体内的米色脂肪细胞就足以诱发小鼠的肥胖以及糖尿病(9)。
这些研究也就表明,米色脂肪细胞在哺乳动物的能量代谢过程中同样起着重要的作用。不过其中的具体分子机制,目前尚不清楚。
在这次的研究中,Kajimura博士团队通过对小鼠进行转基因改造,诱导其白色脂肪组织中产生大量的米色脂肪细胞,然后进行转录组分析,结果发现,相比与白色脂肪组织,米色脂肪细胞中有391个基因的表达显著上调,这些基因主要与细胞的糖酵解,线粒体有氧呼吸以及脂肪酸代谢密切相关。同时,在米色脂肪细胞中,一种名为SERCA2b的蛋白含量显著上升。
这也就意味着,米色脂肪细胞在能量代谢中的作用与SERCA2b蛋白密切相关。
随后通过进一步的研究,Kajimura博士发现,机体产生的肾上腺素可以激活这种名为SERCA2b的蛋白,导致大量的钙离子进入细胞内,使细胞的糖酵解以及线粒体有氧呼吸功能增加近80%,同时摄取和分解大量的葡萄糖以及脂肪酸,产生大量的热量。
 不仅如此,Kajimura博士还发现,在为期24周的高脂饮食中,包含大量米色脂肪细胞的转基因小鼠相比与野生小鼠,体重显著降低,同时对于胰岛素的敏感性也显著增强。这意味着,米色脂肪细胞对于机体的能量代谢稳以及血糖平衡的确具有重要的作用。
不仅如此,Kajimura博士还发现,在为期24周的高脂饮食中,包含大量米色脂肪细胞的转基因小鼠相比与野生小鼠,体重显著降低,同时对于胰岛素的敏感性也显著增强。这意味着,米色脂肪细胞对于机体的能量代谢稳以及血糖平衡的确具有重要的作用。
最后,Kajimura博士通过对猪以及人体米色脂肪细胞进行分析发现,SERCA2b介导的葡萄糖代谢途径不仅存在于老鼠体内,在人体以及猪体内同样存在。同时Kajimura博士认为这或许对于哺乳动物的生存具有重要意义,因为体温的稳定对于哺乳动物生命的维持非常重要。
总的来说,这项研究确定了哺乳动物调节体温以及能量代谢的另一个重要机制,米色脂肪细胞可以通过SERCA2b蛋白增强线粒体功能以促进机体糖和脂肪代谢。这无疑为2型糖尿病以及肥胖的治疗找到了一个全新的靶点。
正如开头所说,这个机制的发现,不得不让人想起生姜来。虽然此前大家都知道吃生姜可以增加我们的机体产热,但是其中的机制并不清楚。而结合此次研究,我们有理由认为,吃姜增加机体产热,是由于生姜中的姜酚能够激活SERCA蛋白,触发米色脂肪细胞燃烧大量的葡萄糖以及脂肪酸。
 Kajimura博士
Kajimura博士
研究人员认为,这也意味着,生姜或许有助于2型糖尿病以及肥胖的治疗。当然了,我们也不可能为了治疗或预防2型糖尿病以及肥胖而吃大量的生姜。因此,Kajimura博士下一步准备将生姜提取物做成药物,用于2型糖尿病以及肥胖的治疗和预防。
参考资料:
1.https://www.nature.com/articles/nm.4429
2.Namekata I, Hamaguchi S, Wakasugi Y, et al. Ellagic acid and gingerol, activators of the sarco-endoplasmic reticulum Ca 2+-ATPase, ameliorate diabetes mellitus-induced diastolic dysfunction in isolated murine ventricular myocardia[J]. European journal of pharmacology, 2013, 706(1): 48-55.
3.Kershaw E E, Flier J S. Adipose tissue as an endocrine organ[J]. The Journal of Clinical Endocrinology & Metabolism, 2004, 89(6): 2548-2556.
4.Cousin B, Cinti S, Morroni M, et al. Occurrence of brown adipocytes in rat white adipose tissue: molecular and morphological characterization[J]. Journal of cell science, 1992, 103(4): 931-942.
5.Seale P, Bjork B, Yang W, et al. PRDM16 controls a brown fat/skeletal muscle switch[J]. Nature, 2008, 454(7207): 961-967.
6.Nedergaard J, Cannon B. UCP1 mRNA does not produce heat[J]. Biochimica et Biophysica Acta (BBA)-Molecular and Cell Biology of Lipids, 2013, 1831(5): 943-949.
7.Shinoda K, Ohyama K, Hasegawa Y, et al. Phosphoproteomics identifies CK2 as a negative regulator of beige adipocyte thermogenesis and energy expenditure[J]. Cell metabolism, 2015, 22(6): 997-1008.
8.McDonald M E, Li C, Bian H, et al. Myocardin-related transcription factor A regulates conversion of progenitors to beige adipocytes[J]. Cell, 2015, 160(1): 105-118.
9.Ohno H, Shinoda K, Ohyama K, et al. EHMT1 controls brown adipose cell fate and thermogenesis through the PRDM16 complex[J]. Nature, 2013, 504(7478): 163-167.
来源:奇点网


{replyUser1} 回复 {replyUser2}:{content}