40年磨剑终成锋 攻克著名“不可成药”靶点背后蕴藏着哪些突破
KRAS基因突变是最早发现的致癌基因突变之一,也是人类癌症中最常见的致癌基因突变。90%的胰腺癌,30~40%的结肠癌,15-20%的肺癌中都存在KRAS基因突变。然而,KRAS也是最为著名的“不可成药”靶点之一,因为它缺乏与小分子药物结合的“口袋”,曾经在过去几十年里,让靶向KRAS的药物开发工作屡屡受挫。
KRAS的“不可成药”性在上周终于被攻破,美国FDA加速批准了安进(Amgen)公司开发的KRAS G12C抑制剂Lumakras(sotorasib,曾名为AMG 510)上市,它成为首款靶向特定KRAS基因突变的抗癌疗法。是哪些科学突破造就了Lumakras的成功?KRAS靶向疗法的未来将走向何方?今天药明康德内容团队将与读者一起回顾突破KRAS“不可成药性”的历程。
揭示KRAS突变体上的隐匿结合“口袋”
在KRAS靶向疗法的研发历史上,2013年在顶尖学术期刊《自然》上发表的一篇论文被认为是改变疗法开发走向的突破性研究之一。在这项研究中,加州大学旧金山分校(UCSF)的Kevan M. Shokat教授率领的研究团队发现了一系列与KRAS G12C突变体特异性结合的化合物。对化合物与KRAS G12C突变体结合的复合体的晶体学研究发现了KRAS G12C突变体蛋白上面存在着一个可以与小分子药物结合的“口袋”。小分子化合物与这个“口袋”结合后能够将KRAS G12C突变体“锁死”在失活的构象,从而为抑制KRAS突变体的活性提供了潜在的靶标。
这篇论文对KRAS G12C蛋白上此前未被发现的隐匿结合“口袋”的研究为KRAS靶向抑制剂的开发提供了一个新方向。安进公司开发的Lumakras和目前处于临床开发阶段的多个KRAS G12C共价抑制剂均靶向这一结合“口袋”。Kevan M. Shokat教授也与Troy Wilson博士,刘异博士和任平达博士联合创建了Araxes Pharma公司,继续进行KRAS G12C靶向抑制剂的开发。UCSF的著名肿瘤学家Frank McCormick博士加入了该公司的科学顾问委员会(scientific advisory board)。
KRAS G12C共价抑制剂的开发
不过,发现能够与KRAS G12C突变体结合的口袋并不意味着开发KRAS靶向抗癌疗法的道路就“畅通无阻”。这是因为,KRAS基因突变之所以被称为致癌突变,是因为突变让KRAS处于与GTP结合的激活状态,这种持续的激活状态促进了癌细胞的产生和增殖。那么问题就来了,靶向KRAS G12C的化合物只能够与处于失活状态的KRAS G12C突变体结合,那么它能够影响到患者的癌细胞里已经处于激活状态的KRAS突变体么?
2016年,Araxes Pharma公司的研究团队对这个问题做出了解答。在Cancer Discovery上发表的一篇论文中,研究人员发现,KRAS G12C突变体虽然被称为激活型突变,但是突变体本身并不是永久处于与GTP结合的激活状态。它仍然会在与GTP结合的激活状态和与GDP结合的失活状态之间快速转换,只不过基因突变让KRAS突变体更有可能处于激活状态。
这个发现给只与失活状态的KRAS G12C突变体结合的共价抑制剂提供了影响激活状态的KRAS突变体的“窗口”,只要在KRAS突变体转换为失活状态时与它们结合,就能够将KRAS“锁死”在失活状态,从而逐渐将细胞中的KRAS都转变为失活形态。这一研究结果打破了认为G12C突变体处于持续激活状态的传统理念,为靶向KRAS G12C的共价抑制剂的治疗潜力提供了重要的佐证。
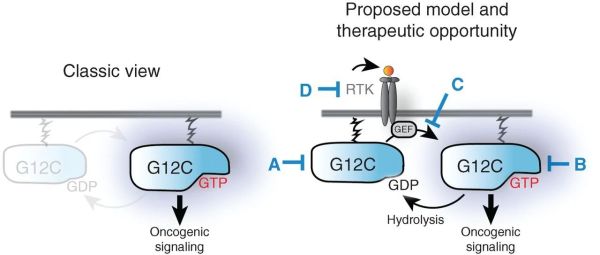
▲KRAS G12C突变体在与GTP结合的激活状态和与GDP结合的失活状态之间的快速转换为共价抑制剂提供了发挥治疗作用的机会(图片来源:参考资料[7])
而共价抑制剂(covalent inhibitors)技术的进展也让研究人员拥有了寻找更有效的KRAS G12C抑制剂的能力。共价抑制剂在与靶点结合之后能够产生共价化学键,从而不可逆地抑制靶点的活性。此前,共价抑制剂的开发常常基于对非共价抑制剂的改造。药物研发人员先找到能够与生物靶点相结合的非共价抑制剂,然后在它们的骨架上添加能够与靶点产生共价键的化学基团。
KRAS G12C共价抑制剂的开发代表着在共价抑制剂开发理念上的一个转变。研究人员直接筛选能够与突变体上的半胱氨酸生成共价键的候选小分子化合物。这种筛选方式虽然没有发现能够与突变体以高亲和力结合的化合物,但是发现了能够与半胱氨酸快速生成共价键的化合物。
“快马加鞭”,将创新疗法送到患者手中
Shokat教授在《自然》杂志上揭示了KRAS突变体新结合“口袋”的晶体结构研究之后,多家生物医药公司投入了沿着这一方向的药物研发。其中,安进公司通过对化合物库的高通量筛选,也发现了靶向KRAS G12C的候选小分子抑制剂。
通常,药物开发是一个漫长的过程,一款药物从最初发现先导化合物到最终获批之间所需的时间经常要在十年以上。然而,在研发人员们的努力下,在2013年的《自然》论文发表之后,安进公司的候选KRAS G12C抑制剂AMG 510在2019年就公布了首个临床试验结果,在10名非小细胞肺癌患者中让5名患者获得部分缓解。
随后,安进迅速开展了关键性2期临床试验CodeBreaK 100,美国FDA也授予了AMG 510突破性疗法认定和优先审评资格,进一步加快这款创新疗法的开发。FDA加速批准Lumakras的时间也比预定的回复时间要早上接近3个月,“快马加鞭”的研发和审评过程让这款创新疗法能够早日送到患者手中。
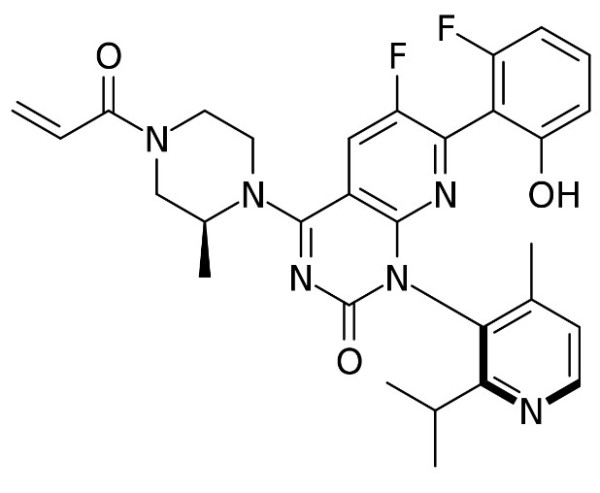
▲Lumakras分子结构式(图片来源:Edgar181, Public domain, via Wikimedia Commons)
KRAS靶向疗法的未来
Lumakras获得FDA的批准无疑是攻克KRAS“不可成药性”的一个重要的里程碑。Lumakras之外,多款靶向KRAS的在研疗法已经进入临床开发阶段,其中Mirati Therapeutics公司开发的adagrasib(MRTX849)有望在今年下半年向FDA递交新药申请。然而,针对KRAS的靶向疗法开发仍然面对着众多挑战。例如,Lumakras虽然在治疗非小细胞肺癌患者时表现出积极的疗效,但是在治疗结肠癌患者时的效果却并不显著。而且,目前的研究已经发现,在临床试验中接受Lumakras治疗的患者能够产生对Lumakras具有耐药性的KRAS突变,从而让Lumakras失效。除了KRAS G12C以外,KRAS还具有很多其它突变类型,而Lumakras对其它突变类型并没有效果。
谈及KRAS靶向疗法开发的未来,Araxes Pharma公司联合创始人刘异博士在接受药明康德内容团队采访时表示,对KRAS抑制剂的耐药性以及在不同癌症类型中疗效不一的问题并不是KRAS靶向疗法面对的独特挑战,这些挑战在所有靶向疗法的开发中都存在。而药物研发行业对这些挑战也有了比较成熟的应对方案。例如组合疗法将会成为克服耐药性突变和扩展KRAS抑制剂适用范围的重要研究方向之一。目前安进公司已经开展十多项临床试验,检验Lumakras与SHP2靶向疗法,免疫检查点抑制剂,以及其它靶向疗法联用的疗效。该公司也在《自然》杂志上发表研究,阐述了KRAS抑制剂组合疗法的研发方向。
靶向KRAS G12C突变体以外,其它药物开发手段也有望取得突破。例如Revolution Medicines公司在开发与KRAS激活状态结合的抑制剂方面已经有近10年的磨练。KRAS蛋白本身虽然缺乏与小分子药物结合的“口袋”,但是Revolution Medicines公司的技术平台另辟蹊径,开发的小分子抑制剂能够与KRAS蛋白和另一个伴侣蛋白构成一个三聚体,让伴侣蛋白和KRAS蛋白联合形成一个与小分子药物结合的“口袋”。靶向KRAS的蛋白降解疗法和通过靶向mRNA抑制KRAS表达的创新疗法也可能对多种KRAS突变体产生效果。
来源:药明康德
版权及免责声明:本网站所有文章除标明原创外,均来自网络。登载本文的目的为传播行业信息,内容仅供参考,如有侵权请联系答魔删除。文章版权归原作者及原出处所有。本网拥有对此声明的最终解释权。


{replyUser1} 回复 {replyUser2}:{content}