在研抗癌新药达1600项 研发时间缩至9年 未来5年研发趋势如何
“从专利申请到获批上市,2020年,这一时间已经缩短到了9年。”IQVIA在其报告《Global Oncology Trends 2021:Outlook to 2025》中提到。
2020年,尽管经历了新冠肺炎大流行,但癌症治疗仍是最受欢迎的临床研发领域,同时也是为行业带来影响力最大的领域,创新疗法与新技术都在该领域得以实践。据统计,包括基因疗法和细胞疗法在内,超过30%的新药针对癌症。
而观察最近五年,无论是创新药获批的数量,还是新药开发从临床走向上市的数量,甚至是FIC的数量都得到了大幅增长,尤其在中国,2015年之后也逐渐加入全球新药获批“高地”的行列。
在研发方面,全球抗肿瘤新药的在研数量也是惊人的,总数近3500种,较2015年增长了75%,同时,尽管新冠肺炎大流行给临床试验带来了困难,但数量依旧在2020年达到了历史制高点1600项。
IQVIA用两个指标来衡量抗肿瘤药研发的发展情况——综合成功率和临床生产力,综合成功率指的是某款药品从临床发展到获批上市的可能性;临床生产力指的是临床成功率、临床试验复杂性以及临床阶段持续时间的综合指标,这两项在五年间皆有所提高。综合成功率由10%提升到了16%,原因在于研发者们将目光向罕见癌症的转移,罕见癌症是普通癌症成功率的5~6倍;临床生产力提高的原因也在于罕见癌症新药的研发。
是什么加速了抗肿瘤新药的获批?又是什么提高了新药研发的成功率?肿瘤新药的研发正在呈现何种趋势?
01 上市新药:抗癌新药研发时间平均已降至9年
在创新药方面,2020年获批的抗肿瘤新药数量依旧在激增。在2015~2020年间,美国批准了62款肿瘤新药上市,涉及24类癌种、超过130项适应证,其中有16个被授予了孤儿药认定;全球其他地区获批数量也实现了超越,中国推出了37款,而这一数字五年前仅为6款;欧洲(包括英国在内)推出了53款。
单看2020年一年,美国共有17款肿瘤新药获批,其中10款基于临床II期试验结果获批,2款基于I/II期临床获批。
肿瘤新药获批所用的时间反映了监管机构对未被满足临床需求的重视,“与已有标准疗法相比疗效改善”或者“缺乏治疗方案”是创新药获批的关键所在。
其中,FIC、突破性疗法认定以及孤儿药等机制成为了加速审批的手段,值得注意的是,基因组学的发展也在加速审批中应用。
在First-in-class方面,2020年有5款抗肿瘤新药获批,包括淋巴瘤新药Monjuvi、上皮样肉瘤新药Tazverik、多发性骨髓瘤新药Blenrep、神经纤维瘤新药Koselugo以及前列腺特异性膜抗原阳性病变的正电子发射断层成像药物gallium 68 PSMA-11。
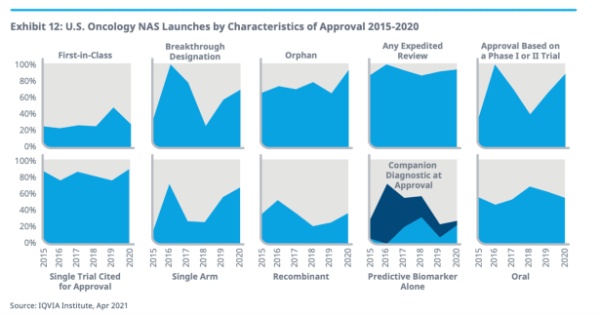
IQVIA统计了2020年以及2015~2020年五年间通过突破性疗法认定、孤儿药认证等多种机制加速获批上市的药物。
2020年,有12款肿瘤新药获批上市前获得了突破性疗法认定,2015~2020年间,有38款获得了突破性疗法认定,获得该认证是药品加速审评审批的手段之一。
对于罕见癌症,2020年有16款新药获得孤儿药认证,2015~2020年间,有49款获得孤儿药认证;
此外,加速审评审批的机制多种多样,2015~2020年间,有57款药物是通过加速审评神审批的方式获批的。
基因检测的应用也是加速审评审批的手段之一,药物基因组学的广泛应用使得诸多药物可以根据相对有限的试验数据、少数研究对象、单一临床试验或者是根据早期临床试验数据的情况下获批的。但相对的,通过药物基因组学获批的药品如果没有得到更广泛的证实,也将会被撤销适应证甚至药品上市批件。
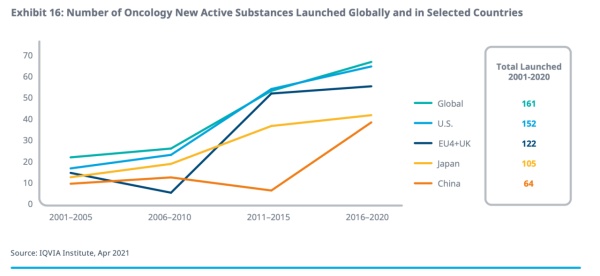
总体而言,进入21世纪,全球抗肿瘤新的活性物共计161种,在2015~2020年间,有64种。
在抗肿瘤新药获批上市方面,近五年,美国推出了62款、欧盟地区(包括英国)43款、日本40款以及中国37款。值得注意的是,中国的抗肿瘤新活性物质获批数量反映出中国药审改革作用明显,从图中可以看到,代表中国的增长明显高于其他国家或地区,以及全球水平。

在2020年,从抗肿瘤新药第一次申请专利到获批上市的平均时间也创下了历史新低,这一时间缩短至9年,无论是审评审批政策还是专利保护政策法规,都显示出了对创新药寿命的保护。
02 研发:临床试验再创新高 中国公司正走上世界舞台
从整体的研发情况来看,2020年,肿瘤领域研发管线中的候选药物数量接近3500个,相比2015年增长了75%,这表明肿瘤领域未被满足的临床需求仍然较大。2020年启动的肿瘤相关临床试验大约有1600个,再创历史新高。
肿瘤药从I期临床试验到监管提交阶段的综合成功率,从2010年的低于10%提高到2020年的15.8%;罕见肿瘤药的综合成功率为32.9%,是常见肿瘤药的5-6倍。2020年,由于针对罕见癌症的II期临床研究的临床开发生产力急剧增加,肿瘤临床开发生产力(成功率、临床试验复杂性和试验持续时间的综合指标)有所改善,但总体开发生产力水平仍显著低于其他疾病。
处于研发早期管线的药物数量大约为1000种,相比2016年增长了43%,主要为包括基因编辑、CAR-T和RNA疗法在内的新一代生物疗法。约80%的肿瘤前期研发管线和三分之二的后期研发管线来自新兴生物制药公司——这些公司每年的研发支出不到2亿美元。在抗癌药研发的740多家公司中,超过500家完全专注于肿瘤领域。
值得关注的是,新兴生物制药公司(年销售额低于5亿美元、研发支出低于2亿美元的公司)控制了近80%的早期管线,但大型制药公司在ADC和BiTE开发中占有相当大的份额。小分子靶向产品包括数十种机制,是管道中最大的领域,主要由较小的新兴生物制药公司主导。在大多数情况下,大公司的研究份额在临床后期会有所上升,究其原因,大公司会通过合并、收购和合作关系进入。
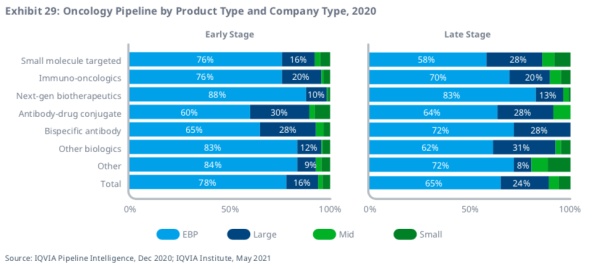
大公司在早期双特异性T细胞受体(BITEs)的早期开发中占有更大的份额,这可能是未来几年会受到持续关注的领域。另外,抗体药物偶联物(ADC)也有更大的早期阶段份额的大公司,这可能是因为,组合药物中往往涉及大药厂已经上市的抗体药物。
新兴生物制药公司的另一特点是,尽管份额在2020年有所下降,但它们依然占据了肿瘤学晚期研发项目的三分之二。在过去的15年里,新兴生物制药公司的贡献一直稳定在65%-67%。同期大型制药公司的份额在24%-27%之间,尽管药物的绝对数量从2005年的98种增加到2020年的243种。
全球共有600多家新兴生物制药公司正在积极开展肿瘤研究项目,还有15家大型制药公司,即全球年销售额超过100亿美元的公司。与2015年相比,新兴生物制药公司拥有的晚期管道份额在2020年下降了2个百分点,这主要是由于一些公司面临COVID-19中断的影响,导致它们的研究项目不再活跃。
同时,有相当数量的小公司,其肿瘤学管线通常只有一个在开发中的分子。IQVIA研究显示,在分子研发方面(以及收入方面),处于领先地位的肿瘤学公司通常会将其整体研发的三分之一以上用于肿瘤学。目前有605家新兴生物制药公司拥有晚期肿瘤管线活动,其中450家100%专注于肿瘤学。
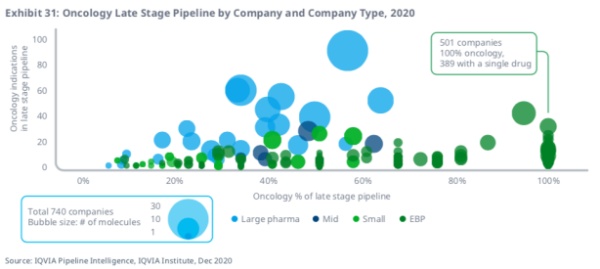
除了这450家100%专注肿瘤学的新兴生物制药公司,另有51家小型公司同样100%专注于肿瘤学。在全部501家公司中,389家公司只有一种药物在开发中。对于这些公司来说,药物开发中固有的风险可能意味着,虽然有一些公司会取得成功,但只有一种在研药物,让研发失败带给公司的风险也随之加大了。
另一趋势是,总部位于中国的公司,生产的药物在早期研发阶段占比已从10年前的3%上升至18%。
从2005年到2015年,美国在全球早期肿瘤研发中的份额保持相对稳定,但是在过去的五年中,美国在这一领域的份额已经下降到45%。同时,欧洲地区所占的份额也从40%下降到26%,但活跃项目的绝对数量从583个上升至639个。
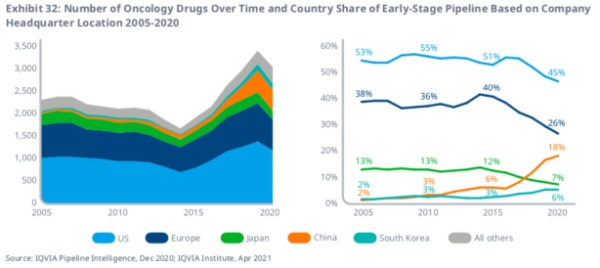
与欧美的情况相反,总部位于中国的公司,处于早期研发管道的产品占18%,比2015年的6%和2005年的2%有所上升。
同时,研究显示全球有13%的新一代生物治疗药物由总部位于中国的公司进行开发。
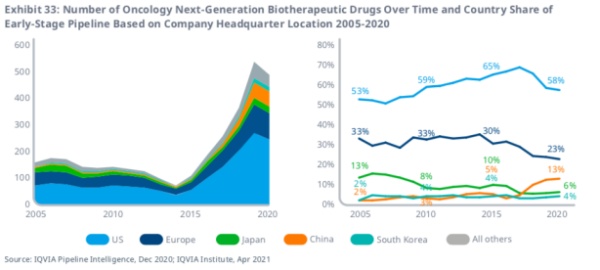
到2017年,美国在全球下一代生物治疗药物早期研发中的份额一直在上升,达到69%,但此后下降了11%,而同期中国的份额大幅上升了10%,达到13%。在过去的五年中,欧洲项目的份额从30%下降到23%,而活跃项目的绝对数量从26个上升到92个。中国公司的产品目前占新一代生物治疗早期生产线的13%,比5年前的5%和2005年的2%有所上升。
注:本文编辑自IQVIA报告《Global Oncology Trends 2021:Outlook to 2025》
来源:E药经理人
版权及免责声明:本网站所有文章除标明原创外,均来自网络。登载本文的目的为传播行业信息,内容仅供参考,如有侵权请联系答魔删除。文章版权归原作者及原出处所有。本网拥有对此声明的最终解释权。


{replyUser1} 回复 {replyUser2}:{content}