CRISPR基因编辑遇见抗癌细胞疗法 强强联手将带来哪些突破?
近年来,细胞疗法在治疗癌症方面表现出优异的疗效,目前已经有5款CAR-T疗法获得美国FDA的批准,多种同种异体CAR-T疗法,T细胞受体(TCR)-T细胞疗法,以及肿瘤浸润淋巴细胞(TIL)疗法也在临床试验中获得佳绩。CRISPR基因编辑技术作为一种简便有效的突破性基因编辑技术,问世以来,不但在基础科学研究领域得到广泛应用,在临床应用方面也不断获得突破,无论是体外编辑还是体内编辑都获得可喜的临床进展。
那么,将CRISPR基因编辑技术与抗癌细胞疗法结合能够碰撞出什么样的火花?近日发布的一篇综述描述了使用CRISPR基因编辑技术改良抗癌细胞疗法的前景。
基因编辑生成“通用型”同种异体CAR-T疗法
目前获得批准的CAR-T疗法都需要从患者体内获得T细胞,在体外进行改造和扩增,然后再输回患者体内。这种自体细胞疗法的生产工艺耗时耗力,而且有些患者因为疾病进展速度快,或者无法提供足够的健康T细胞而无法接受它们的治疗。
解决这些局限的一个主要方向是开发基于健康供体提供的T细胞而生产的同种异体的“通用型”CAR-T细胞疗法。这一策略可以提前进行细胞疗法的生产,它们可以用于及时治疗不同患者。然而,由于供体的T细胞表面表达着独特的T细胞受体和人类白细胞抗原(HLA)。这一策略面临的重大挑战之一是患者的免疫排斥(患者免疫系统攻击输入的细胞疗法)和移植物抗宿主病(输入的细胞疗法攻击患者的健康组织)。
基因编辑提供了一种敲除供体T细胞的TCR和HLA的方法,而CRISPR/Cas9基因编辑系统因为其灵活性和高效的编辑能力,成为敲除TCR和HLA表达的有力工具。以往的临床前实验显示,利用表达嵌合抗原受体(CAR)的慢病毒载体可以递送多个指导RNA(guide RNA),同时敲除内源性TCR和HLA-1等多个蛋白的表达。
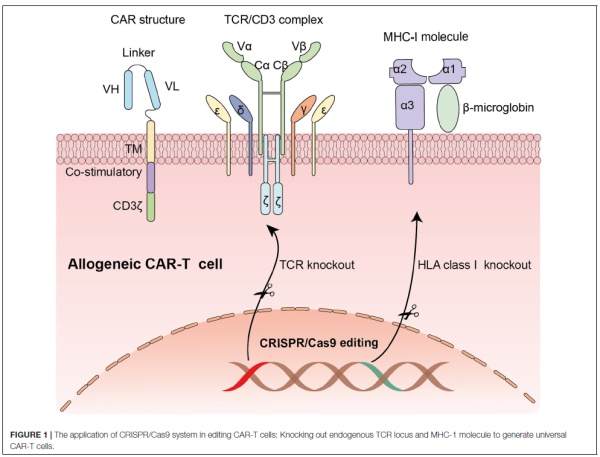
▲利用CRISPR/Cas9基因编辑系统可以敲除内源性TCR和HLA,生成“通用型”CAR-T细胞疗法(图片来源:参考资料[1])
而且,使用CRISPR/Cas9技术还可以将表达CAR的序列特异性地插入到细胞的T细胞受体α恒定区(TRAC)的基因位点,带来CAR的一致性表达。在体外和小鼠模型中,这种方法生成的CAR-T细胞与常规CAR-T细胞相比,表现出增强的抗癌活性。
利用CRISPR基因编辑增强T细胞疗法抗癌活性
困扰CAR-T疗法疗效持久性的另一个因素是T细胞耗竭和具有免疫抑制特征的肿瘤微环境。目前的研究已经发现多种免疫检查点蛋白能够起到抑制T细胞活性或者促进T细胞耗竭的效果,包括PD-1, CTLA-4,LAG-3和TIM-3等等。因此,CRISPR基因编辑系统已经在临床前研究中被用来敲除这些免疫检查点蛋白,旨在增强CAR-T细胞疗法的抗癌活性和持久性。
在异种移植癌症模型中,使用CRISPR基因编辑敲除PD-1表达,让CAR-T细胞表现出更强的清除PD-L1阳性肿瘤的活性。
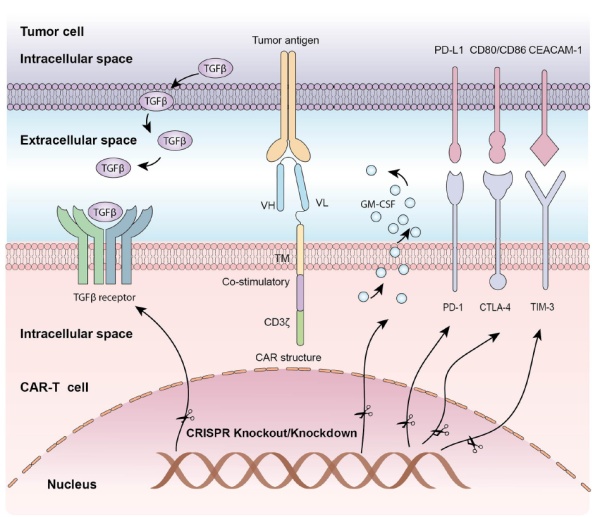
▲利用CRISPR基因编辑系统,可以敲除或敲低多种抑制CAR-T细胞疗法活性的基因(图片来源:参考资料[1])
日前,由诺奖得主Jennifer Doudna教授联合创建的Caribou Biosciences公司宣布,该公司利用CRISPR基因编辑敲除PD-1表达的同种异体CAR-T疗法,已经在治疗复发/难治性B细胞非霍奇金淋巴瘤的1期临床试验中完成首例患者给药。
CRISPR在改造TCR-T细胞疗法方面的应用
虽然CAR-T疗法在治疗血液癌症方面疗效显著,但是它们在治疗实体瘤方面尚未表现出类似的显著效果,缺乏在肿瘤细胞表面表达的特异性抗原靶点是限制CAR-T细胞在实体瘤领域应用的原因之一。而TCR-T细胞疗法因为可以靶向肿瘤内部表达的抗原,在治疗实体瘤方面可能具有更好的前景。
TCR-T细胞疗法的生成需要在T细胞上表达能够与肿瘤细胞呈递的抗原复合体结合的T细胞受体。阻碍TCR-T细胞疗法的一个主要原因是T细胞内源性TCR的表达。它们可能与转基因TCR发生竞争,阻碍转基因TCR的表达和与CD3受体的结合。内源性TCR还可能与转基因TCR形成异二聚体,影响它们与抗原复合体的结合。
CRISPR基因编辑系统可以敲除内源性TCRα和β基因,并且将它们替换成肿瘤特异性TCR序列。这种基因编辑与其它技术结合,能够几乎100%地消除异二聚体的产生,从而改善TCR-T细胞疗法的抗癌活性。
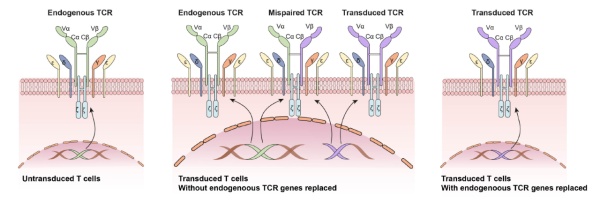
▲CRISPR基因编辑系统可以敲除内源性TCRα和β基因,消除异二聚体的产生(图片来源:参考资料[1])
宾夕法尼亚大学Abramson癌症中心的Stadtmauer教授团队已经在临床试验中证明,使用CRISPR技术可以成功敲除内源性TCR,生成的靶向NY-ESO-1抗原的TCR-T细胞疗法在3名患者中表现出良好的安全性。它们可以患者体内扩增,并表现出对肿瘤的靶向性。
改善肿瘤浸润细胞的抗癌活性
在治疗实体瘤方面,肿瘤浸润细胞(TIL)疗法已经在临床试验中表现出出色的疗效。例如,Iovance Biotherapeutics开发的TIL疗法在治疗晚期宫颈癌、黑色素瘤和非小细胞肺癌患者时都显示出可喜的缓解率和缓解持续时间。这种疗法从患者的肿瘤组织中分离肿瘤浸润细胞,在体外进行培养和扩增,然后输回到患者体内。
然而,它遇到的潜在问题是从肿瘤组织中获得的TIL数目相对较少,需要在体外进行大幅度扩增。而大幅扩增的过程可能让TIL进入分化状态,当它们再被输回到患者体内后会更快地进入耗竭状态,导致疗法效果降低。
而通过CRISPR基因编辑,可以敲除TIL细胞中的免疫检查点蛋白,让TIL在体外扩增之后仍然保留分化程度较低的干细胞特征,从而延长TIL细胞疗法的持久性。
明尼苏达大学(University of Minnesota)的研究人员已经启动一项临床试验,将使用CRISPR基因编辑系统敲除TIL细胞中的检查点基因CISH,在胃肠道癌症患者中检验用这一方法扩增的TIL细胞疗法的效果。
发现更多增强细胞疗法疗效的基因
CRISPR基因编辑系统作为一种工具,能够高特异性地编辑T细胞的基因组,这让研发人员有机会对多个用药物无法靶向的基因进行改造,从而从不同角度增强细胞疗法的抗癌活性。而且,CRISPR基因编辑系统的另一项应用——CRISPR筛选,已经被研发人员用来筛选能够提高免疫疗法疗效的基因靶点。目前已经有多项研究发现了新的T细胞激活调节因子,T细胞代谢调节因子,以及抗原处理/呈递通路和干扰素通路中的创新靶点,为CRISPR基因编辑提供了更多的靶点。
来源:药明康德
版权及免责声明:本网站所有文章除标明原创外,均来自网络。登载本文的目的为传播行业信息,内容仅供参考,如有侵权请联系答魔删除。文章版权归原作者及原出处所有。本网拥有对此声明的最终解释权。


{replyUser1} 回复 {replyUser2}:{content}