免疫检查点火遍全球 蛋白激酶检查点何时发力?
免疫检查点抑制剂,在过去的5年中赢得了临床也收获了市场,可以说是新药研发和投资领域最火热的品种。检查点(Check point)的概念,也因此而更加被研究者所熟识。然而,并不是所有的检查点都获得了如此的成功,同样是研发热门的蛋白激酶所对应的检查点,虽有品种进入临床,但尚未得到足够的临床证实,品种管线的集中发力,尚需要破冰之旅。主要信息请看本稿件。
Chk1靶点特点
结构上,人类Chk1(check point kinase 1)基因编码含476个氨基酸、分子量54kD的蛋白激酶;包括四个结构域:N端激酶结构域、可变连接域、调节域和抑制性结构域。功能上,正常细胞周期中Chk1蛋白激酶调节S期DNA的复制、G2/M过渡期、有丝分裂期的进入以及M期纺锤体检测点。
图1.1 Chk1抑制剂对应的PDB数据
(图片源:PDB数据库)
Chk1与肿瘤的关联,主要是与DNA损伤反应(DDR)相关。DDR,是指当DNA受到损伤时可激活细胞周期检测点,以调节细胞周期的转换、DNA的修复和有丝分裂,主要相关ATR、Chk1、ATM和Chk2这四种蛋白激酶。
当DNA受到损伤刺激时,会使复制叉减慢或停滞,暴露出单链DNA(ssDNA),它被复制蛋白A(RPA)束缚,引起一些蛋白积聚在停滞的复制叉上,激活蛋白激酶ATR,ATR磷酸化激活其效应激酶Chk1,Chk1磷酸化靶细胞来执行DNA复制压力检测点的功能,涵盖细胞周期的阻滞或停止、稳定复制叉、控制复制起源点释放和复制重启等。
进一步的分子水平,ATR-Chk1途径相对于ATM-Chk2途径,能识别更为广泛的DNA损伤。DDR过程,Chk1蛋白激酶首先可诱导阻止细胞周期;为确保DNA复制在细胞进入有丝分裂前完成,检测点通过抑制CDK1的活性来阻滞细胞周期,而CDK1的活性取决于Wee1激酶和Cdc25c磷酸酶的平衡状态,Chk1蛋白激酶可正性调节Wee1蛋白激酶、负性调节Cdc25c磷酸酶。其次,S期Chk1蛋白激酶通过CDK2阻止DNA复制起始因子Cdc45,从而减慢DNA复制速度,为修复争取时间来维持基因组完整性。再次,DNA修复过程中,Chk1蛋白激酶可诱导PCNA泛素化,从而激活跨损伤翻译合成DNA聚合酶,以取代经典的聚合酶,绕过修复受损部位,进行DNA复制;最后,Chk1蛋白激酶能诱导细胞调亡,在DNA损伤情况下使p73表达和转录活动增加,从而诱导细胞凋亡。
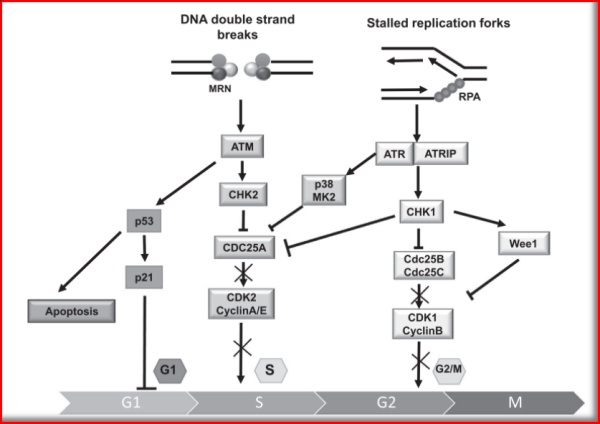
图1.2 CHK1/2主要的信号通路
(图片源:Radiotherapy and Oncology)
Chk2的结构和功能
与Chk1相比,人类的Chk2基因可编码分子量60kD、543个氨基酸组成的丝氨酸/苏氨酸蛋白激酶;同Chk1一样,Chk2在正常组织细胞尤其是细胞核中广泛表达,可见于细胞周期的各个阶段,并且具有明显的组织特异性。
当DNA发生DDR后,尤其是DNA双链发生断裂损伤(DSBs),可以通过ATM-Chk2-Cdc25信号通路激活G1/S期、S期和G2/M期这三个时期相对应的检查位点,对DNA损伤进行修复,使细胞周期进程发生阻滞;如果DNA的损伤是不可修复的,Chk2激酶还可诱导DNA损伤的细胞凋亡,这种凋亡途径分为P53依赖型和P53非依赖型两种。
图2.1 Chk1抑制剂对应的PDB数据
(图片源:PDB数据库)
全球Chk1蛋白激酶抑制剂的开发
化疗、放疗,在一定程度上会损伤肿瘤细胞的DNA,从而杀死增殖中的肿瘤细胞;同时,激活依赖于相关蛋白激酶的DDR和细胞周期检查点,来抵抗这种损伤,维持肿瘤细胞的存活。所以,抑制Chk蛋白激酶的活性,可以使肿瘤细胞失去这种修复能力,从而增强化疗和放疗对肿瘤细胞的杀伤。不过,就现今研发状态而言,Chk1抑制剂较Chk2抑制剂具有相对更好的临床证据,研发进度也相对较快。但即使如此,全球针对Chk1蛋白激酶所开发的多款抑制剂,尚无品种获批上市,具体品种见下图。
表3.1 全球Chk1蛋白激酶抑制剂主要品种

具体临床品种介绍
如上所述,当前尚无Chk1蛋白激酶抑制剂获批上市,最高临床阶段为临床II期,主要有默克的MK-8776、Eli Lilly and Company的LY2606368、LY2603618;I期品种主要有阿斯利康的AZD7762和Sierra Oncology公司的SRA737。

SCH900776(MK-8776)
开发公司为默克,属Chk1蛋白激酶高选择性抑制剂,可以减弱癌细胞中DNA的修复能力。研究表明,MK-8776可以增加细胞毒药物如吉西他滨的细胞毒,且不增加正常组织的细胞毒。
另,MK-8776能增强人结肠癌细胞对顺铂和铂复合物细胞毒性作用的敏感性,与顺铂或铂复合物联合治疗,会导致G1、S期相关的细胞凋亡、M期的刺激和HCT116细胞衰老的明显增加,但癌细胞对药物组合的反应受p21、p53和PTEN状态的影响,因此,SCH900776可作为在结肠癌细胞中由铂类药物触发的细胞毒性反应的重要调节剂。另,在对三阴性乳腺癌相关细胞系的放射敏感性的研究中,SCH900776可通过抑制辐射诱导的自噬现象来增加人类TNBC的放射敏感性。

LY2606368和LY2603618
开发公司为Eli Lilly and Company,LY2606368是一种高选择性ATP竞争Chk1蛋白激酶抑制剂;癌细胞中,能抑制Chk1自磷酸化和诱导H2AX的磷酸化,且已在许多恶性肿瘤中进行临床试验。在体外和体内的小细胞肺癌模型中,显示出较强的单一药效,并能增强顺铂或PARP抑制剂奥拉帕利的作用,提高铂耐药模型的反应。在BRCA1/2突变的乳腺癌和卵巢癌、TNBC以及转移性前列腺癌的研究中已进入Ⅱ期试验。
LY2603618,同样为高选择性的Chk1激酶抑制剂,主要被用作肿瘤治疗中的化疗增敏剂。在非小细胞肺癌中已进入Ⅱ期试验,可改善患者的无进展生存期。在很多肿瘤中产生了明显的效果,如:恶性黑色素瘤、套细胞淋巴瘤、鼻咽癌等。

AZD7762
开发公司为阿斯利康,属ATP直接竞争性Chk1/2蛋白激酶抑制剂,可有效抑制cdc25c肽的Chk1磷酸化,IC50值为5nM,Ki值为3.6nM。在KRAS/p53/LKB1细胞系和KRAS/p53/LKB1诱导的肺癌小鼠模型中,肿瘤细胞的DNA有很高的损伤率,从而使Chk1蛋白激酶依赖的检测点功能增强,用AZD7762与DNA损伤药物吉西他滨协同治疗能减少在这些模型中的肿瘤大小,尤其是在极具侵袭性和攻击性的LKB1型肺腺癌中。临床试验方面,主要是联合吉西他滨、伊立替康用于安全性、耐受性、以及相关的剂量爬坡试验。
小结与思考
综上,大体为蛋白激酶检查点抑制剂当下的开发情况。总的来说,这一方向的药物推进处于稳步研究当中,尚无临床爆点数据;同合成致死方向的药物一样,尚需要更强的临床数据证明。不过,合成致死领域PARP抑制剂近年来的全球销售增长,正在刺激着这一条线上药物的研发进度,一旦形成临床上的突破,势必会诞生重磅炸弹级别品种,总体还是很值得关注与期待。
来源:新浪医药
版权及免责声明:本网站所有文章除标明原创外,均来自网络。登载本文的目的为传播行业信息,内容仅供参考,如有侵权请联系答魔删除。文章版权归原作者及原出处所有。本网拥有对此声明的最终解释权。


{replyUser1} 回复 {replyUser2}:{content}