百济恒瑞砸百亿来学 CDE手把手教 难倒药企的出海第一课
6月,史上最大规模的新一轮集采落下帷幕。
在这场对中国存量市场的争夺中,药企的“内卷”已渐超市场想象,强如恒瑞医药,也要面对在造影剂领域中的出局。
集采与医保控费不断压缩着国内的市场空间,基于现实的支付能力,未来十年药企很难实现持续性的高增长已成共识。
这样的境遇之下,出海寻找增量,成了许多寻求转型的传统药企与追求first-in-class的创新药企共同的选择,创新药的全球上市也成为一种策略趋势。
然而,药企国际化要闯过的第一关,便是全球多中心临床试验。
这对于习惯了仿制,对临床试验并不在行的中国企业来说,挑战不亚于一个新药的早期临床研发。
7月2日,针对目前国内抗肿瘤药物临床研发上的诸多问题,CDE发布了《以临床价值为导向的抗肿瘤药物临床研发指导原则》的征求意见通知。
业内普遍认为,这一指导原则提升了国内肿瘤药临床研发的标准,为中国临床试验与国际标准的进一步接轨打下基础。
事实上,从加入ICH开始,伴随着药品审评审批领域的持续改革,中国的全球临床之路已慢慢走上坦途。为提升临床研发的质量,百济神州、恒瑞医药等国内企业也开始尝试在海外筹建自己的临床团队,药企国际化正进入2.0时代。
根据CDE的最新数据,截至7月19日,中国登记的国际多中心试验已达到1126项,约占全部临床试验数量的8.31%。
“一些中国药企成长得非常快,正非常努力地构建其全球化发展的生态基础。相信未来中国制药在国际舞台上一定会拥有不一样的天地。”科文斯中国区总经理夏文璐对E药经理人表示。
01 暴跌背后的临床痛点
7月的第一周,整个医药股都笼罩在暴跌的阴霾之中。Wind数据显示,7月5日到9日的一周,医药板块跌幅达到3.95%。
在CDE的这份被业内称为“中国PD-1供给侧改革”的临床新规中,已明确指出,新药研发应以为患者提供更优的治疗选择为最高目标。
这意味着,未来的临床方案,在设计之初,就应考虑以市场上最好的肿瘤创新药为参照,这无疑将大大提高创新药的质量,也更有助于遴选出更多高质量的first in class药物。
尽管从各方解读来看,新规对中国创新药的发展都是一个绝对利好,但也因其带有“去伪存真,肃清乱象”的属性,对医药股的估值泡沫形成了挤压。7月6日,医药医疗股全线大跌,包括CXO、医疗服务、创新药、仿制药、疫苗等板块无一幸免,泰格医药、美迪西、诺泰生物等多只股票跌幅超过10%。
新规剑指抗肿瘤药的临床方案,而这恰恰是中国创新药的痛点。
在向全球最好的临床标准看齐的监管导向之下,如何更好地设计一个国际多中心临床试验,将成为药企出海的必修课。
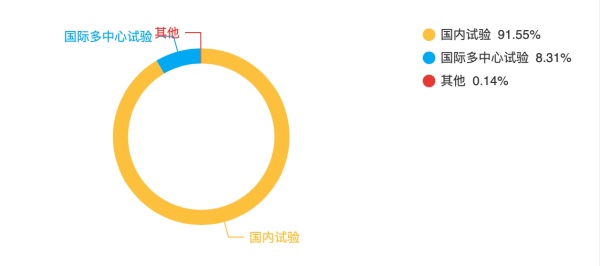
中国临床试验试验范围 数据来源:药物临床试验登记与信息公示平台
“我研究过不少抗肿瘤药物的临床方案,发现国内做PD-1的药企中,除了几家top,大部分在试验的设计上都千篇一律,相互copy。过去大家都做仿制药,对设计阶段不太在意,别人翻译成中文这么做,那我也这么做。药企的思维如果一直固化在这个层面,是比PD-1扎堆更值得警惕的事情。”科临达康董事长郭东升指出。
在他看来,只要想做创新药,国际化就是必经之路。对于只有“全球新”、能打硬仗的产品才有底气布局海外这一点,药企如今是普遍认同的,但大家忽略的是,光有好产品是不够的,还应辅以一个同样好的研发策略和试验设计。
“而如何通过试验设计,把临床前的一个好品种成功转化到临床试验上去,进而开发出来,是整个中国创新药的一个痛点。”郭东升称,如果有一个强有力的团队,可以为产品找到好的目标人群,哪怕它是在一个很窄的人群里有优势,也可以走向海外。企业完全可以通过策略性的设计,实现低样本量、低时间成本的国际临床试验。
夏文璐也认同,在国际多中心的临床试验中,一些本土药企在研发策略上的经验尚有欠缺,global CRO公司整个体系也没有很多对接我们本土企业的经验,都在不断提高和优化过程中,科文斯也在不断反思如何能更好地支持这一类客户的出海项目。
她目前看到的问题主要在两个方面:
一是企业对海外不同市场的法规理解不深入,对项目方案设计中可能的风险评估不是很充分,包括海外对一些实验室的技术和方法学方面的要求可能更高,之前国内做出来的数据,未必能用到海外申报。有的项目可能已开始临床启动,资金投入也很大,但在和欧盟或美国药监部门进一步的沟通后,才发现之前的设想有一些“硬伤”,导致后续的研发策略要有很大的改动。“除了药企的研发团队,CRO的中国和global注册、医学等部门,都要非常紧密地沟通各国药研法规的变化,监管重点的演变趋势等,并落实到具体项目的客户沟通和实施上,才能使可能出现的风险得到及时的评估。”夏文璐表示。
二是药厂与研发外包的各合作方之间的沟通合作,其实是一个相当复杂的系统性工程,涉及到不同领域的很多企业以及相应的法规。对于本土企业出海的国际多中心项目,一个项目在计划、实施、出现问题时,什么时间点要和哪些stakeholder沟通和确认什么事项,先后的次序以及重要等级,这些对项目组成员的要求是非常高的。经验不足,沟通不到位,非常容易延误项目,甚至引起各团队之间的矛盾和不信任感,这也势必更影响合作的质量。目前来看,无论是药企还是CRO,真正具备全局观和优秀沟通能力的项目负责人还是很稀缺。加强跨BU的培训和有效沟通,提升项目负责人的综合能力,也是global CRO在修炼的另一项内功。
对于刚刚开启新药出海的中国药企来说,完成一项国际多中心试验,是一个全方位的大挑战。
“国家与国家之间在标准治疗、病人基础治疗情况,医疗体系的工作习惯等方面存在很大差异,非常考验企业的临床试验管理能力,绝对不是包给CRO就完了。即使是国际头部CRO公司,也无法为你保证临床试验的实施完全顺利。”希毅医学负责人邓晓宇表示。
而对临床试验的管理不力,最容易导致的结果是“有效性的一致性评价”出现偏差,这将极可能造成一个全球多中心临床试验的失败。目前,已有国内药企在此踩坑。
郭东升指出,在全球的临床实践中,因为执行标准的不一致,时有数据偏移的现象发生,企业需要对此密切关注。
“我经常看到一种情况,在试验的进行过程中,统计、数据和医学团队的介入度不够,只是在项目结束时才去做报告,最后一分析,发现某个中心有问题,可已经晚了,所有的数据已收集完毕,结果很难改变。这就是企业在临床的管控上出了问题。”
郭东升认为,好的解决办法是成立一个数据监察委员会,周期性地对试验进行评估,在过程中就对它进行控制。
“我们可以每次挑选五例或十例来进行分析,如果发现依从性偏差,就看看中心出了什么问题,能不能解决,如果不能解决,那就把它关闭。总体来说,是完全可以通过统计在试验的过程中就出具报告来发现它。”郭东升表示。
夏文璐也指出,不同国家,因为人群的差异经常会导致数据的偏差。
她曾遇到过一个CNS领域的项目,在国外验证过不同性别的病人群做出阳性结果,但是在国内进行临床试验后,得到的结果与国外试验并不完全一致。当时的医学和统计等专家团队为此做了多角度的深入分析,最后发现可能是不同国家的文化差异,以及性别差异,对同一个问题,病人的理解和回应不同所导致的。
“多区域之间的种族敏感性与地区差异性是一个客观现实,可所有参与中心往往需要面对同一个研究假设,使用同样的对照药和具有临床意义的主要终点。这样的情况很难完全避免,但在推动全球研发策略时,从多维度对临床设计进行考量很必要,包括缜密地设计数据监察委员会的参与等。”夏文璐表示。
在今年的DIA大会上,CDE化药临床一部审评员王朝云也对国际多中心临床试验的设计给出建议。
她提醒称:“人群方面,不同国家人种的差异和非药物干预如饮食、文化等在设计试验过程都需要考虑;剂量上,也需要先考虑区域间的不同因素,可咨询各地的专家来判断临床实验的设计是否有可行性及符合当地的实践;样本量的分配方式上,企业要考虑亚洲人群合并后是否有相似的特征,然后再考虑中国的样本量。”
02 美澳VS新兴市场:出海去哪儿?
根据科睿唯安的数据,2015年时,国内企业仅在海外的14个国家开展临床试验,项目数只有48项。而到了2019 年,中国药企在海外临床试验的布局国家已超过50个,累计项目总数超过340个。
长久以来,药企出海最偏爱的两个区域是美国和澳洲。最近两年,欧洲和新兴市场国家也逐渐成为海外开展临床试验的热门区域。
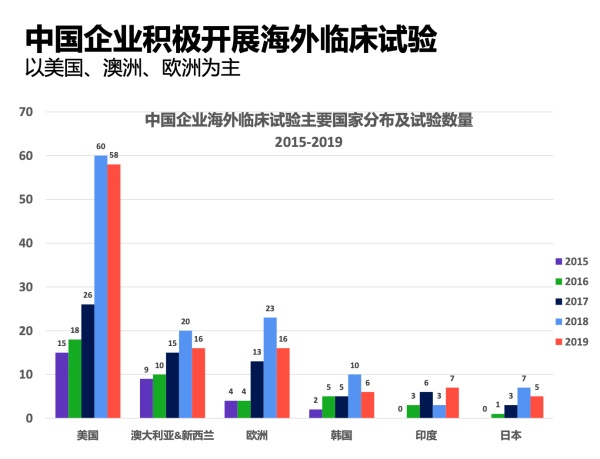
数据来源:科睿唯安Cortellis临床试验情报
而在疾病种类上,近年来,中国药企出海临床主要集中在肿瘤和胃肠消化领域。除此之外,在内分泌系统、神经与精神系统、自身免疫系统也多有涉及,尤为值得一提的是,海外临床连续多年都有涉及到罕见病。
目前,在海外开展临床试验最多、布局最广的中国药企是百济神州,其临床项目遍布美国、澳洲、欧洲和亚洲的日韩,特别是在欧洲的项目数量远超国内其他企业。
而恒瑞医药、山东绿叶、和记黄埔、亚盛药业、齐鲁药业等也紧随其后。
恒瑞医药的海外研发以澳洲为主,其次是美国,在欧洲的布局也渐渐开始。山东绿叶以美国为主,和记黄埔以欧洲为主,而齐鲁制药则以印度为主要布局地。
邓晓宇认为,药企喜欢去美国做试验,是因为美国作为医药研发强国,临床试验数量多,范围广,整个产业研发策略、质量标准和项目经验都是很成熟的。
“以肿瘤为例,美国医生有很多机会参与最新的临床试验,所以很专业很识货,只要是真正的好产品,他们一定会很快让自己的病人用上,入组也很迅速。但是有些产品就得不到美国研究者的认可,入组十分困难,临床难以推进。”邓晓宇称。
除了美国之外,澳洲因为拥有良好的医学研究基础设施和多种族的人口结构,也获得不少国内药企的青睐,常以此为起点进行I期II期临床,进而布局整个国际多中心试验。
“澳洲有很好的法规框架,能够支持药企更早拿到临床病人的临床反馈数据,对申报材料的要求也相对简单。比如说有些口服的药还没有装胶囊,也可以在当地药房里装进胶囊先上临床试验,如果数据积极便立刻向前推进。很多药企在临床研发布局上可能会先去澳洲,II期时换到中美,III期放到全球。”邓晓宇表示。
天津药物临床研究技术创新中心高级总监马竹琳也认为,澳洲最大的好处是性价比,临床试验资源不错,水平不低,价格相对欧美大国也有竞争优势。“但它也有缺点,如果你要做一些罕见病的试验,受试者的招募就比较困难,基数并不大。”
而对于欧洲,因为人口较少,成本较高,中心又比较分散,国内药企通常都是在III期试验中才将它纳入布局。
“欧洲的医疗界话语权也很大,因为一些主流的研究者基本都在这些发达国家,如果产品想在欧洲上市的话,应该提前布局。但是他们的患者入组很慢,且因为医药研发比较发达,医保制度也好,所以必须是好产品才会被选择,不是太有竞争力的产品过去,很可能找不到受试者。”邓晓宇指出。
而对于印度,邓晓宇直言,去印度的企业一般是看重当地仿制药的研发能力,印度在仿制药领域的服务产业比较成熟。
最近两年,伴随着新冠疫苗和药物的研发,中国药企临床试验地的选择越来越多样化。2020年底,科技部副部长徐南平表示,我国正与阿联酋、巴西等16个国家合作开展国际多中心Ⅲ期临床试验研究。
相比欧美等传统的临床试验地点,新兴市场的竞争压力似乎要小很多。特别是在患者的招募上,因为这些国家拥有大量未接受过治疗的患者和积极主动的调查人员,招募过程往往很迅速,患者的留存率和依从性也很好,脱落率较低。
但去新兴市场布局也可能要面临一些“拓荒”上的难题,比如供应链。
在今年的DIA大会上,泰格医药的临床运营部总监吴宝林曾以冷链物流为例,分享过他的经历——
在国内做临床试验,冷链物流只是一个很小的模块,涉及的管理计划也许是最微不足道的。因为国内有顺丰等公司,可以很好地做到合规运输。
但在海外做多中心临床时,冷链则可能成为很大的问题。
泰格在巴基斯坦开展临床项目时就注意到,2到8摄氏度的疫苗运输,包装耗材里面熔点的温度应该是5摄氏度左右,而当地并没有5摄氏度熔体的相应冰包,只有0摄氏度的。
“这该如何解决?如果到了当地才发现问题,肯定来不及了。这就需要在前期预判到各种可能性,包括你认知以外的事,提前去做完整的合规性核查。包括帮当地去组建保持相应温度的整个流程,从国内进口耗材甚至物流冷链的所有的设备,重新组织这一链条,让他们有能力去做合规的运输。”吴宝林称。
随着越来越多的企业将海外临床的地点放在新兴市场,全球的CRO/CMO产能也开始向新兴市场转移。国外大型CRO企业如艾昆纬、科文斯、PPD、精鼎等企业正陆续以合资、设立独资企业或收购等方式进军中国和其他新兴市场。
“从前中国的生物医药企业,对管理一个横跨多个大洲,多个语言,多个监管环境的大范围临床试验并没有太多经验。而疫情的爆发,则让中国企业必须站出来参与这种国际性的大规模协作,在短时间里建立起全球临床试验的管理能力,搭建研究中心网络,快速招募受试者入组。这种能力一旦具备以后,将会被复用,未来我们中国企业牵头全球项目的机会将越来越多。”邓晓宇对此充满期待。
03 成本之惑
6月28日,百济神州的科创板上市申请获得通过,有望成为首个实现A股、港股和美股三大市场上市的药企。
在此之前,百济神州刚刚宣布,其BTK抑制剂泽布替尼对比伊布替尼用于治疗复发或难治性慢性淋巴细胞白血病/小淋巴细胞淋巴瘤患者的头对头全球3期多中心临床研究ALPINE的中期数据,达到了客观缓解率(ORR)的优效性,并取得了显著的无进展生存期(PFS)获益。
在中国药企的国际化征途中,百济神州出发的较早,目前也走得最远。
在谈到百济出海的经验时,百济神州高级副总裁、全球研发负责人汪来认为,打造一个属于自己的全球临床研发和运营团队至为重要。
“现在我们做临床试验已不需要依赖CRO了,尽管海外开发的成本确实很高,可一旦我们可以自己做全球多中心的临床试验,就能保证试验更高质、更快速地推进,与临床中心和医生也可以更直接、更紧密地沟通。有了自己的团队,总的临床运营成本其实是下降的。”汪来表示。
据了解,百济神州的研发团队分工非常细致,一个产品对应的若干个适应症,每个都有专业的人来把控。这使得别的药企做70分的事情,百济可以做到90分。
而目前,百济神州在全球的员工近6000人,海外员工超过千人,在公司官网的高管团队中,有一半是海外面孔。一系列投入也使其研发费用在药企中一骑绝尘,数据显示,2020年百济神州的研发费用高达84亿元人民币。
以泽布替尼的研究为例,其“单挑”伊布替尼的成本就不菲。汪来曾透露,伊布替尼造价昂贵,在头对头试验中,一个慢淋患者一年的花费就在80万人民币左右。这意味着,光是为300多个入组患者持续3到5年地购买伊布替尼这一项花费,就将达到7到12亿元。
“百济的魄力和国际化的视野,在中国生物医药企业中是不多见的。”邓晓宇表示,除了中美澳,其临床试验布局还覆盖到其他国家,说明公司完全是瞄准全球市场在进行临床和市场的开发。
和百济神州一样积极布局海外的,还有恒瑞医药。
2009年,恒瑞医药向FDA申请创新药瑞格列汀在美国进行临床实验,并获得批准,成为中国第一家进行“中美双报”的药企。
虽然是第一家吃螃蟹的公司,如今也有近20个项目获准开展全球多中心临床研究,但恒瑞医药的高管去年仍坦言,公司的国际化程度尚未达到自己预期的目标。
近年来,恒瑞逐渐意识到,想要解决国际多中心临床试验中的运营和质控难题,在海外自建团队势在必行。2020年年报中,公司明确提出:要“加快打造专业化、属地化的研发团队,推动更多产品进行国际多中心临床试验”。
去年,恒瑞医药在瑞士巴塞尔建立了欧洲临床中心。截至目前,公司在美国、欧洲、澳洲、日本等多地都已建有研发中心和临床医学部,全球研发团队达到4700人,2020年研发费用已接近50亿元。
为了更好地实现全球布局,恒瑞表态称,未来在产品立项时,会综合考虑国际市场,进行临床设计时,也会针对中外市场的不同单独设置策略。
“像百济与恒瑞这样在海外‘下一盘大棋’,是需要非常大的资源投入的,并不是所有药企都有这样的能力。”马竹琳表示。
她认为,对中小药企来讲,仅仅是在海外寻找一个可以对接监管机构和研究中心,顺利推进项目执行的CRO,成本就已不低,若想和国际一线CRO公司合作,投入将更大。
“且CRO是服务提供方,企业自身需要一个可以与之对接并管理它工作的团队,这又会进一步地增加成本。不仅如此,在中国企业把产品研发推向海外的同时,也要多方面考量未来产品上市或license-out的可能性,这也需要企业在研发、注册和执行方面有内部专家。”马竹琳表示。
人才的瓶颈正在制约药企国际化的脚步,其中,能够驾驭和管理全球临床试验的人才尤为紧缺。
“现在欧美归国的人才中,生物学、化学、工程背景的科学家多一些,但有全球临床试验管理经验的人才相对较少。试验管理更像是一门经验科学,讲究实操性,没有多年的一线工作经验很难成长为成熟的管理人才。而长久以来,中国的临床试验人才更多的是参与,而不是领导全球多中心研究。所以这方面,国内药企还存在一个比较大的人才缺口。”邓晓宇分析。
他的建议是,药企做海外临床时可以尝试先从海外引进优秀的外籍临床人才,实现业务的快速成长,然后在具体的项目中慢慢培养自己的人才,两条腿走路,既不耽误进度又能尽快实现有机增长。
而目前,一些国内药企已经开始在跨国药企招兵买马。
马竹琳就注意到,她在跨国企业做临床运营的一些很优秀的国外同事,现在已经加入了百济神州和恒瑞的海外团队。“如果说过去我们的人才还总是被外企挖走的话,那现在趋势反过来了。这也从侧面证明中国药企国际竞争力的提升。”
在夏文璐看来,只有一两家企业冲出来是不够的,像百济和恒瑞这样的企业越多,中国在国际舞台上发出的声音才能越响亮。而这种凝聚力是需要在企业间紧密的合作中,在人才的培养和流动中逐渐形成的,中国医药产业的国际化生态需要所有企业共同构建。
“临床研究人才就像一棵棵树,在浪潮中快速成长,而所有的药企和CRO共同努力,它就会变成一片生机勃勃的森林。全球多中心临床试验的先进经验和各类人才已经通过各个渠道流入中国,成为中国医药产业共同的财富。等到中国形成自己的国际影响力,一定会看到我们中国的药企在创新药领域越来越强。”夏文璐表示。
但她同样认为,全球研发和运营效率能力的提升,不是一蹴而就的。对于想要出海的中小药企来说,应该一步一个脚印,先找到可以深度合作的伙伴充分沟通,建立信任,一起解决问题并练好内功,把国际多中心临床试验的的机制和合作模式理清楚,然后在项目中不断优化管理体系并增加自己的风险管控经验值。这样可以避免踩坑,团队也会得到很好的锻炼,积跬步,致千里。
来源:E药经理人
版权及免责声明:本网站所有文章除标明原创外,均来自网络。登载本文的目的为传播行业信息,内容仅供参考,如有侵权请联系答魔删除。文章版权归原作者及原出处所有。本网拥有对此声明的最终解释权。


{replyUser1} 回复 {replyUser2}:{content}