诺华Q2财报:哪些创新研发项目获得突破?
今日,诺华(Novartis)公司公布了2021年第二季度的财报。诺华首席执行官Vas Narasimhan博士指出,在第二季度,诺华的多种创新疗法获得可喜临床结果,其中包括使用创新治疗技术平台的在研疗法。下面将与读者分享诺华高管着重介绍的最新研发突破。
Asciminib:有望变革慢性髓系白血病标准治疗
诺华公司在季报中宣布,已经向美国FDA递交asciminib的新药申请(NDA),用于治疗费城(Ph)染色体阳性慢性髓系白血病(CML)经治患者。Asciminib是一款ABL1别构抑制剂,它与ABL1肉豆蔻酰口袋(myristoyl pocket)结合,抑制BCR-ABL1的活性。由于它与BCR-ABL1结合的位点与常见酪氨酸激酶抑制剂(TKI)不同,因此可能解决CML患者后期治疗中对TKI耐药和不耐受问题。
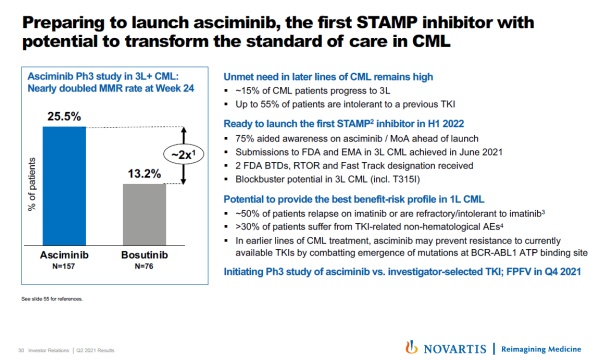
▲Asciminib有望改变CML患者的标准治疗(图片来源:参考资料[2])
Asciminib在今年2月获得美国FDA授予的突破性疗法认定。在3期临床试验中,与活性对照相比,它将患者的主要分子学反应率(MMR)提高了接近一倍。诺华指出,如果获得批准,asciminib将是首个与ABL1肉豆蔻酰口袋结合的抑制剂。
177Lu-PSMA-617:下半年递交新药申请
177Lu-PSMA-617是诺华重点开发的潜在“first-in-class”靶向放射配体疗法(RLT)。它通过与前列腺癌细胞表面的前列腺特异性膜抗原(PSMA)结合,将放射性同位素靶向递送到肿瘤内部,在杀伤肿瘤细胞的同时,降低对周围健康细胞的损害。
在今年ASCO年会上公布的数据显示,与最佳标准治疗相比,177Lu-PSMA-617将转移性去势抵抗性前列腺癌(mCRPC)患者的死亡风险降低38%,放射学疾病进展或死亡的风险降低60%。它在今年6月获得FDA授予的突破性疗法认定。
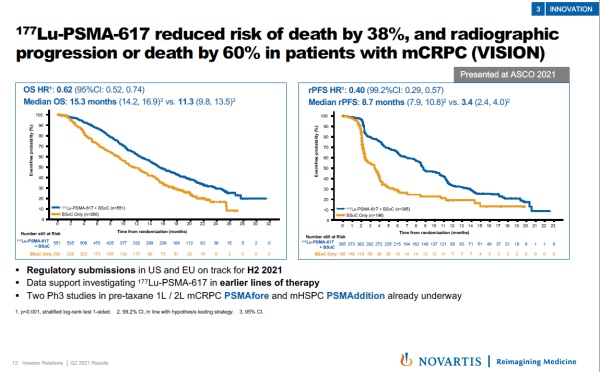
▲177Lu-PSMA-617的3期临床试验结果(图片来源:参考资料[2])
诺华预计将在今年下半年向美国和欧盟监管机构递交177Lu-PSMA-617的监管申请。同时,该公司在进行两项3期临床试验,检验177Lu-PSMA-617治疗更早期前列腺癌患者的潜力。
Sabatolimab:治疗血液癌症获得初步积极结果
Sabatolimab是一款靶向TIM-3受体的潜在“first-in-class”单克隆抗体。TIM-3大多在免疫细胞和髓系白血病细胞表面表达,其水平与急性髓系白血病(AML)和骨髓增生异常综合症(MDS)的严重程度相关。Sabatolimab创新性地同时靶向髓系白血病细胞和免疫细胞,不但可以杀伤癌细胞,而且可能增强免疫细胞的活力。
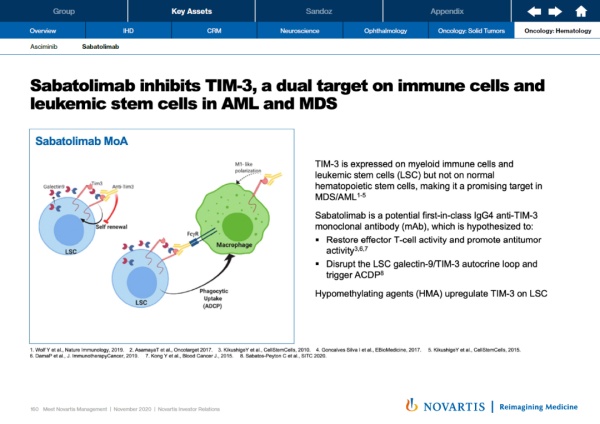
▲Sabatolimab作用机制(图片来源:诺华官网)
在今年欧洲血液学协会(EHA)年会上公布的数据显示,sabatolimab与低甲基化药物联用,在AML和MDS患者中获得可喜的持续应答。在MDS患者中的总缓解率为58%。目前,它在多项2期和3期临床试验中与其它疗法联用,治疗MDS和AML患者。
siRNA疗法Leqvio:有望今年获得FDA批准
Leqvio(inclisiran)是诺华通过收购The Medicines Company,获得的靶向PCSK9的“first-in-class”siRNA疗法。它通过降低PCSK9的表达水平,降低患者体内的“坏”胆固醇水平。患者有望每年仅接受两次治疗,就能够维持低密度脂蛋白胆固醇(LDL-C)水平的降低。
Leqvio在去年底获得欧盟批准上市,不过在接受FDA审评时,受到COVID-19的影响,对疗法生产基地的审核未能顺利进行。诺华表示,已经向FDA重新递交监管申请,解决了疗法生产基地审核的问题。这一申请的PDUFA日是2022年1月1日。
基因疗法Zolgensma:让脊髓性肌萎缩症儿童达到正常发育里程碑
Zolgensma是诺华公司开发的用于治疗脊髓性肌萎缩症(SMA)的基因疗法,旨在通过一次静脉输入,在体内持续表达运动神经元生存蛋白,治疗导致SMA的遗传根源。它是美国FDA批准的第一款治疗SMA的基因疗法。
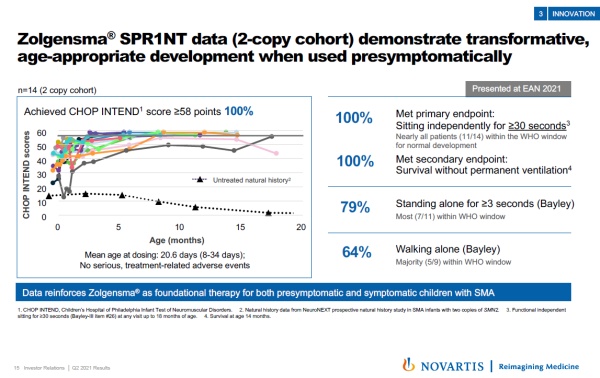
▲Zolgensma在尚未出现症状时就接受治疗的SMA儿童中的临床试验结果(图片来源:参考资料[2])
最近公布的SPR1NT临床试验结果显示,在SMA儿童尚未出现疾病症状时就使用Zolgensma,能够显著提高患者的运动能力。在14名接受治疗的患者中,100%的儿童达到独立坐起超过30秒的主要终点。进一步强调了它作为出现症状和尚未出现症状SMA患者的基石性疗法的潜力。
Iptacopan:治疗多种补体驱动的肾脏疾病
Iptacopan是一种口服特异性替代补体途径因子B抑制剂,能高效抑制补体替代通路中因子B。它可能在治疗多种替代通路功能异常导致的疾病同时,不影响其它补体通路介导的对微生物入侵的免疫反应,降低患者受到感染的风险。
最近公布的临床试验结果显示,iptacopan在治疗IgA肾病和C3肾小球病患者的两项2期临床试验中获得积极结果,显著降低蛋白尿,并且稳定患者的肾功能。
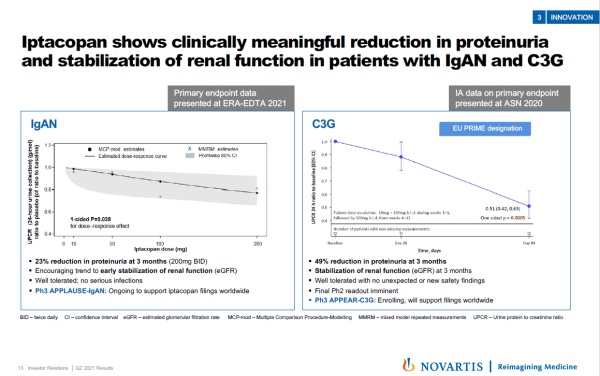
▲Iptacopan治疗IgA肾病和C3肾小球病患者的临床结果(图片来源:参考资料[2])
此外,今年6月在欧洲血液学协会(EHA)年会上公布的新数据显示,iptacopan在治疗阵发性睡眠性血红蛋白尿症(PNH)患者的2期临床试验中获得积极结果。显著降低患者的乳酸脱氢酶(LDH)水平(这是血管内溶血的生物标志物),并且提高患者的血红蛋白水平。
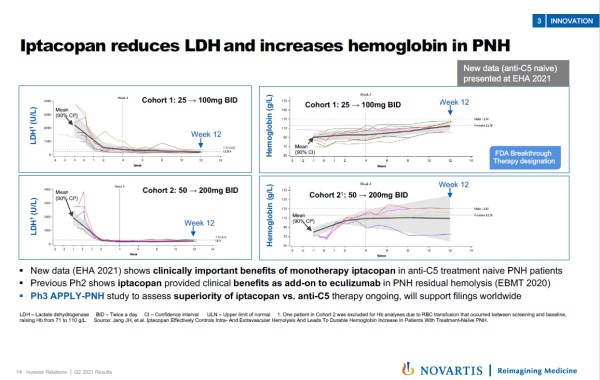
▲Iptacopan治疗PNH患者的2期临床试验结果(图片来源:参考资料[2])
目前,iptacopan在多项3期临床试验中接受检验,治疗IgA肾病,C3肾小球病患者和PNH患者。
截至第二季度末,诺华的研发管线中共有159个研发项目。诺华公司的Q2报告中对部分研发项目也做了简要介绍。限于篇幅,本文不再赘述。
来源:药明康德
版权及免责声明:本网站所有文章除标明原创外,均来自网络。登载本文的目的为传播行业信息,内容仅供参考,如有侵权请联系答魔删除。文章版权归原作者及原出处所有。本网拥有对此声明的最终解释权。


{replyUser1} 回复 {replyUser2}:{content}