P53的好搭档MDM2 一个潜在的重磅靶点?
P53,于肿瘤领域的热度,绝对处于第一梯队,虽仍未有药物上市,但并不影响研究者对它的热情。在很难攻破P53这个靶点的基础上,研究者逐渐将力量分散于其周边靶点以及整个信号通路,其中,与之形成复合物的MDM2,自然吸引了大量研究,且当前最高已处于临床III期。
那么,作为P53的好搭档,MDM2会成为一个潜在的重磅靶点吗?国内外都投入了哪些力量于其中?请看本稿件。
不得不说的抑癌基因“P53”
P53,可以说是肿瘤领域一个极热的靶点,同时也是一个极具争议的靶点。之所以热,是因为几乎所有的人类肿瘤中均存在P53信号通路的异常,近50%的恶性肿瘤中存在P53的突变,被广泛的定义为抑癌基因。而极具争议,是因为历经40年的开发,仍无上市药物。
生理状态下,P53蛋白的表达水平很低,且呈动态;细胞受刺激后,磷酸化的P53与MDM2/MDMX复合物解离,蛋白水平升高,激活;P53的持续高水平,又导致了PUMA、BAX等凋亡相关基因的转录,引发细胞凋亡,从而抑制肿瘤的发生。
图1.1 P53信号通路(与MDM2相关度极大)
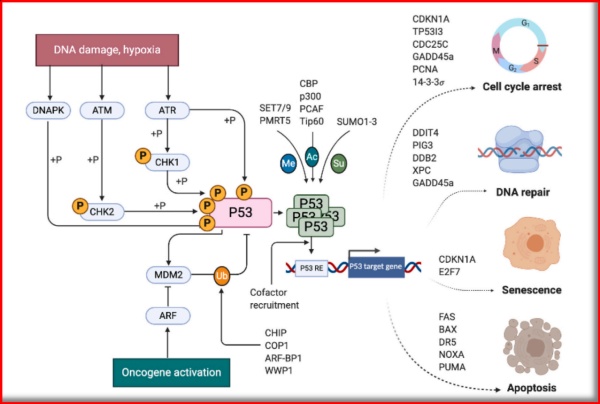
(图片源:BBA - Reviews on Cancer 1876 (2021) 188556)
MDM2靶点特点
在P53诸多负反馈调节机制中,最核心的机制是由MDM2及其同源异聚复合蛋白MDMX实现;MDM2可以抑制P53的转录活性和稳定性,同时MDM2是P53的靶基因,表达水平受到P53的调控。另,MDM2具有可以抑制P53诱导凋亡的能力,但MDMX可能具有抑制P53诱导细胞周期阻滞的能力。故,MDM2被认为是与P53关联最为紧密的功能靶标。
结构上,MDM2的N端P53结合结构域可以结合到P53的转录激活结构域,阻碍P53与其共转录激活因子的结合,抑制P53靶基因的激活;另一方面,MDM2的C端RING(Really Interesting New Gene)结构域具有E3泛素连接酶活性,可以泛素化降解P53和MDMX,同时其自身也可被泛素化。
图2.1 MDM2/MDMX多维度控制P53稳定性
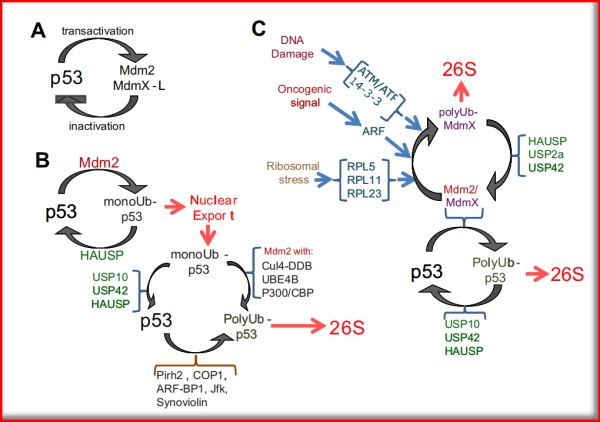
(图片源:FEBS Letters 586 (2012) 1390–1396)
全球临床在研药物
Nutlins3a,是首个被证明可以有效抑制P53与MDM2间的相互作用的小分子MDM2抑制剂,基本结构是多取代的二氢咪唑,二氢咪唑环上的疏水性取代基可模拟P53N端与MDM2结合的关键疏水性残基。为了提升活性,有研究者对其结构进行优化,又合成了众多活性更优的化合物,如RG7112 (RO5045337)和RG7388(RO5503781,III期);其他公司或机构也开发了MDM2抑制剂,具体见下图。
图3.1 临床试验中靶向P53和/或MDM2的代表性小分子
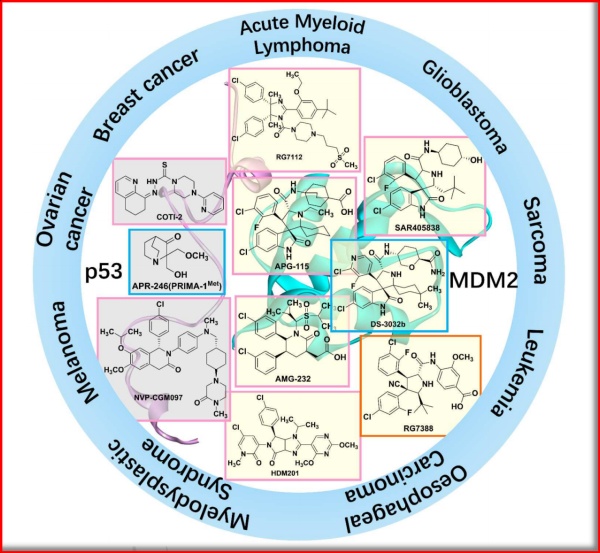
(图片源:European Journal of Medicinal Chemistry)
首个进入临床研究的P53-MDM2蛋白-蛋白相互作用抑制剂,为罗氏制药开发,RG7112。而目前进展最快的,同为罗氏制药公司开发的2代MDM2小分子抑制剂,即RG7388,现已进入临床III期;而早在2011年,即开展了3项临床针对I期,分别用于评估RG7388用于治疗晚期恶性肿瘤、单独或联合阿糖胞苷治疗急性髓性白血病、以及联合泊沙康唑治疗实体瘤时的药物相互作用。
其他品种:如AMG-232,是由安进公司开发,是从头设计的新型骨架;而DS-3032b是由第一三共公司开发,现已进入II期。
国内专利申请
针对于MDM2这个靶点,我国申请相关专利的申请人类型是以企业占比最多,大于80%,其次为高校,再为研究机构和个人。
企业方面,国外对MDM2抑制剂进行布局的企业主要有诺华股份、豪夫迈·罗氏、霍夫曼-拉罗奇、美国安进、第一三共株式会社等。
而国内,当前对于该靶点进行布局的药企并不多,主要有江苏申琅生物、亚盛医药、南京明德新药、上海长森药业等。
来源:新浪医药
版权及免责声明:本网站所有文章除标明原创外,均来自网络。登载本文的目的为传播行业信息,内容仅供参考,如有侵权请联系答魔删除。文章版权归原作者及原出处所有。本网拥有对此声明的最终解释权。


{replyUser1} 回复 {replyUser2}:{content}