近日发表的一篇深度综述指出,PROTAC分子的成功揭示了理性设计异双功能分子的前景,根据目标靶点,可以利用双功能分子招募不同的效应子,达到特定的效果,这一策略具有变革新药开发的潜力。
历史上,新药开发的过程可以分为三个阶段,依靠不知道确切活性分子的天然产物,知道确切的分子信息但是不知道具体的作用机制,以及理性药物设计。近年来PROTAC分子等靶向蛋白降解剂就是理性药物设计的一个代表。近日发表的一篇深度综述指出,PROTAC分子的成功揭示了理性设计异双功能分子(heterobifunctional molecules)的前景,根据目标靶点,可以利用双功能分子招募不同的效应子,达到特定的效果,这一策略具有变革新药开发的潜力。

异双功能分子的设计自从2001年以来日渐受到关注,它们通过将内源性效应子与蛋白靶点拉近产生作用。其中,PROTAC分子能够将E3连接酶募集到靶点蛋白附近,促进它们的泛素修饰,并通过蛋白酶体降解。
值得一提的是,在蛋白酶体之外,细胞的自噬系统、内体/溶酶体、磷酸化通路、核酸酶(RNase)都可以被招募。它们不但可以用于靶向降解蛋白,还可以对它们进行转译后修饰(PTMs)。异双功能分子不但可以特异性降解蛋白,还可以特异性降解RNA。
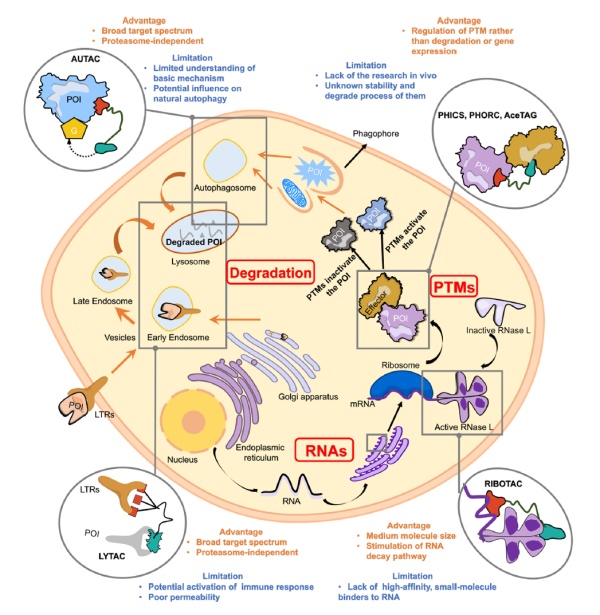
▲异双功能分子用于新药开发的潜在方向(图片来源:参考资料[1])
蛋白酶体之外,内体/溶酶体也是细胞降解蛋白的重要平台。在2020年7月,Carolyn R. Bertozzi教授的研究团队在《自然》杂志上发表了突破性研究,介绍了称为LYTAC的蛋白降解技术。这种双特异性分子的一端能够与细胞外蛋白结合,另一端能够与CI-M6PR受体结合,形成的复合体会被细胞吞噬,并且送到溶酶体中进行降解。新一代的LYTAC分子能够成功引导肝细胞对细胞外蛋白的吞噬,从而完成组织特异性LYTAC降解。
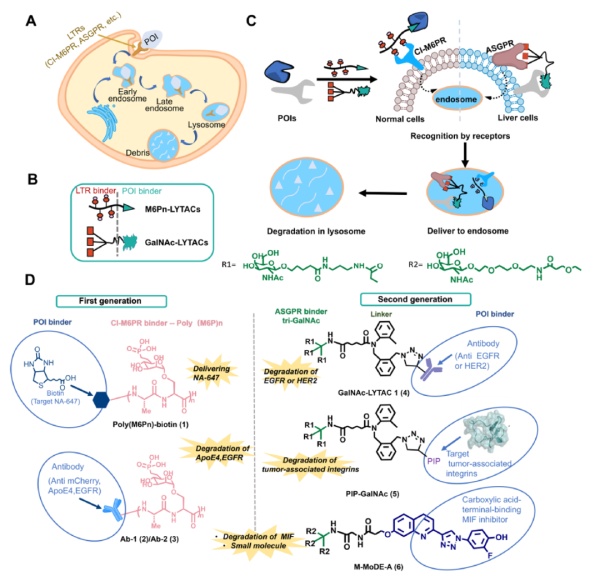
▲LYTACs作用机制和代表性化合物(图片来源:参考资料[1])
综述作者表示,LYTAC分子是PROTAC分子很好的补充,可以用于降解PROTAC分子无法靶向的细胞外蛋白和细胞膜蛋白。它们是治疗与这些蛋白相关疾病的重要工具,比如由于G蛋白偶联受体或离子通道功能失常导致的疾病。自噬系统在溶酶体介导的细胞内物质降解方面具有重要作用。它可以降解广泛底物,包括受损的细胞器、聚集的蛋白、和细胞内废物。第一代AUTAC分子和新一代称为AUTOTAC的分子将靶向靶标蛋白的分子与激活自噬作用的小分子化合物连接起来。它们在体外和动物实验中,已经显示出有效清除细胞内蛋白聚集体的能力。
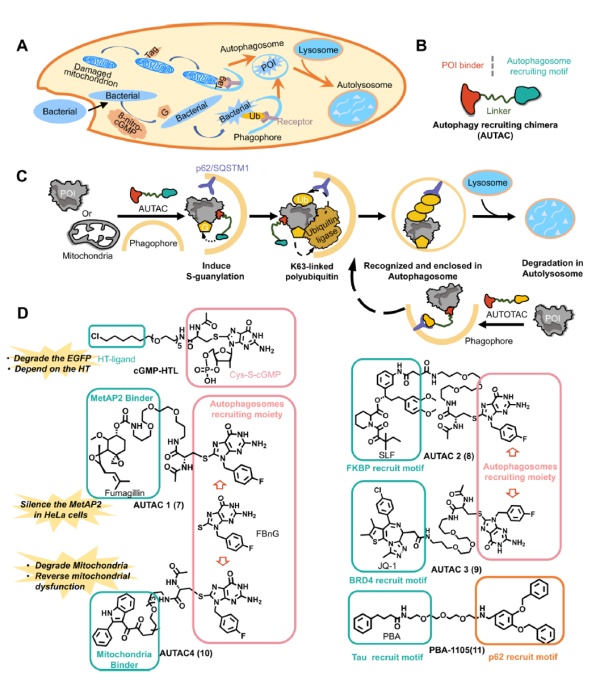
▲AUTACs作用机制和代表性化合物(图片来源:参考资料[1])
综述作者表示,AUTAC/AUTOTAC分子进一步扩展可以降解的细胞内靶标的范围。值得一提的是,这一技术可以用于靶向降解与疾病相关的聚集蛋白,即使它们的功能未得到完全澄清。比如,与神经退行性疾病相关的tau蛋白聚集体,与心脏疾病相关的免疫球蛋白轻链聚集体等等。理论上,AUTACs可以在不影响野生型蛋白的情况下特异性降解聚集体。除了靶向降解靶点蛋白,异双功能分子还可以介导对靶标的转译后修饰,从而调节它们的功能。
靶向降低蛋白磷酸化——PHORCs/PhosTACs蛋白的磷酸化和去磷酸化是最重要的转译后修饰之一,因为它们与调节多重生物功能相关。2019年,募集磷酸酶的异双功能分子的研究首次发表,研究人员利用双功能分子,将PP1磷酸酶募集到AKT和EGFR附近并且导致靶点蛋白的去磷酸化。基于这一发现,PROTAC研究的先驱之一,耶鲁大学Craig M. Crews教授的课题组开发了名为磷酸化靶向嵌合体(PhosTACs)的分子。它们能够募集丝氨酸/苏氨酸蛋白磷酸酶2A(PP2A),对PDCD4蛋白和FOXO3a蛋白进行去磷酸化。综述作者指出,PHORCs/PhosTACs是通过调节靶点蛋白磷酸化,精准改变其功能的有力工具。由于它不影响蛋白的表达水平,因此可能可以避免降解蛋白造成的潜在不良副作用。它还可以用于治疗由于靶点过度磷酸化导致的疾病。比如,阿尔茨海默病的标志性特征之一是超级磷酸化的tau蛋白形成的神经原纤维缠结。目前的蛋白激酶抑制剂在抑制tau蛋白磷酸化方面并未表现出足够的特异性。PHORCs/PhosTACs技术可以提供靶向tau蛋白磷酸化的另一种机制。
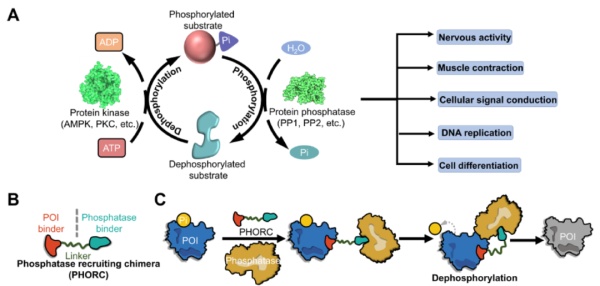
▲PHORCs/PhosTACs的作用机制(图片来源:参考资料[1])
如前所述,蛋白激酶在调节底物磷酸化状态中也起到重要作用。很多细胞信号通路的激活依赖蛋白激酶的磷酸化功能。PHICS的作用机制与前面提到的PHORCs/PhosTACs相反,通过将内源性蛋白激酶招募到靶点附近,提高靶点蛋白的磷酸化。
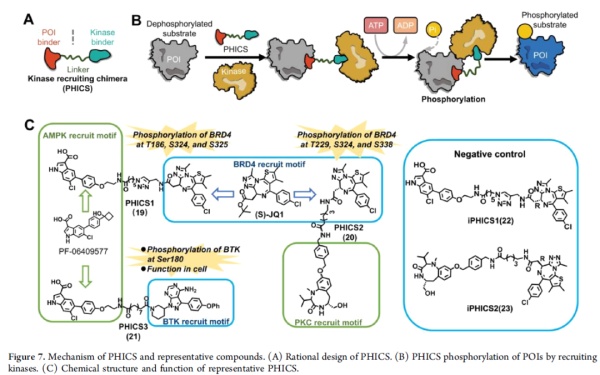
▲PHICS的作用机制和代表性化合物(图片来源:参考资料[1])
赖氨酸的乙酰化是另一种非常常见的蛋白转译后修饰。它们出现在超过10000个人类蛋白位点上,与基因转录,DNA损伤修复、蛋白折叠和信号传导相关。比如对组蛋白的乙酰化修饰可以通过表观遗传学影响多种基因的表达。科学家们已经开发出调控蛋白乙酰化的异双功能分子。名为AceTAG的系统先用基因工程给靶标蛋白加上一个的“标签”,然后将靶向这个“标签”的配体与招募乙酰转移酶的分子连接起来,生成特异性添加乙酰基团的异双功能分子。这一系统可以弥补传统乙酰化调节剂的缺陷,并且扩展乙酰化调节的蛋白范围。
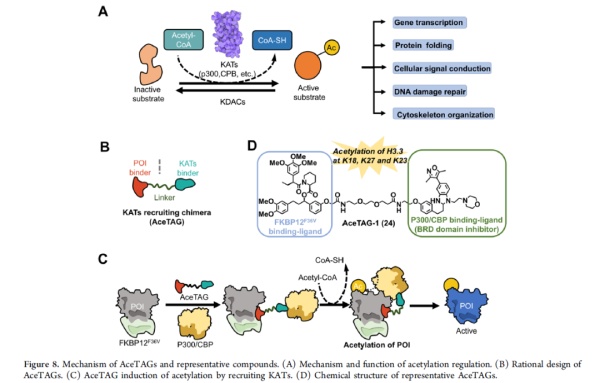
▲AceTAGs的作用机制和代表性化合物(图片来源:参考资料[1])
异双功能分子不但可以作用于蛋白,还可以介导对RNA分子的靶向调节。
RIBOTAC分子的作用方式是将靶向RNA的配体与招募内源性RNase的基团连接在一起,从而将RNase拉近到特定RNA附近,激活RNase特异性切割靶标RNA。RIBOTAC提供了靶向不可成药蛋白的另一种策略。而且,它提供了靶向非编码RNA的机会,这些非编码RNA占转录组的70%,影响多种疾病的进展。与基于序列靶向RNA的RNAi疗法和反义寡核苷酸(ASO)疗法相比,RIBOTAC的小分子特性让它们可能具有更好的药理学特征。而且一个RIBOTAC分子可以重复使用,降解超过一个RNA分子,这增强了RIBOTAC的效力。
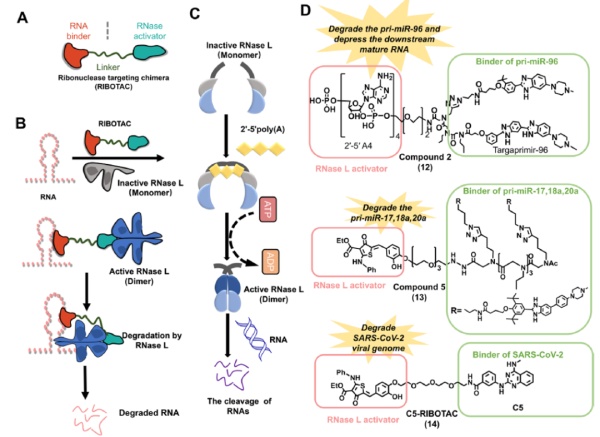
▲RIBOTAC的作用机制(图片来源:参考资料[1])
作者表示,受到PROTACs的启发,科学家们已经开发出越来越多的异双功能分子,能够招募E3泛素连接酶之外越来越多的效应子。这些新系统不但能够弥补PROTACs的不足,而且进一步扩展了异双功能分子的应用范围。目前,这些异双功能分子的开发是新药开发备受关注的领域之一。然而作者表示,这一领域也面临多重挑战。未来的研究需要进一步对作用机制进行深入了解,包括嵌合分子的靶标特异性研究和三元复合体(靶标/异双功能分子/效应子)形成的动力学分析。这些研究有助于避免脱靶效应,并且有助于设计更有效的分子。此外,开发高亲和力和选择性的配体有助于提高异双功能分子的活性。目前用于招募效应子的配体有限,有的配体不但亲和力不高,而且可能抑制效应子的活性。如何有效招募效应子又不抑制它们的活性是设计异双功能分子的一大关键挑战。最后,改良目前异双功能分子的成药特征是研究的一个重要方向。由于分子量较大,目前很多异双功能分子的PK特征,溶解性和细胞渗透性不高。未来,在优化现有分子特征的同时,作者预计科学家们将开发招募更多效应子类型的能力,进一步丰富对靶点的调节。简言之,异双功能分子丰富了理性药物设计的理念,可以具有针对性地选择靶标蛋白和招募匹配的效应子,达到预期的调节效果。这一策略有望为小分子药物开发带来革命性的变化。










{replyUser1} 回复 {replyUser2}:{content}