奥株新冠疫苗研发竞速!辉瑞、Moderna吃力追赶,国内厂商瞄准海外
自2021年12月以来,新冠病毒Omicron(奥密克戎)变异株成为全球新冠肺炎疫情的主要流行毒株。而奥密克戎变异株持续进化演变,越来越多的亚分支出现,这也增加了针对主流新冠病毒的疫苗等开发难度。
WHO数据显示,截至2022年6月14日,全球在研新冠疫苗已有166个进入临床试验阶段。目前全球已获批附条件上市或紧急使用的新冠疫苗产品已接近40个。
一边是全球火热的研发热潮,一边是不断变异的病毒,在持续加码投资下,新冠疫苗厂商研发的成本、风险等也越来越变得不可控。
FDA建议推出针对性疫苗
药企开发吃力追赶
据外媒报道,本周二,美国FDA的独立疫苗专家小组以19比2的投票结果,建议在今年秋天接种针对奥密克戎变体的新型新冠疫苗,公共卫生官员们预计届时将出现新一轮新冠病例激增。
CNN报道称,FDA独立的疫苗和生物制品咨询委员会(VRBPAC)支持推荐在新冠疫苗加强针中加入Omicron特定成分。他们认为,改良的疫苗将提供更广泛的保护,以匹配现在流行的冠状病毒毒株。
目前,BA.4和BA.5两个Omicron亚型在美国主导着新冠病毒传播。数据显示,BA.4和BA.5已成为南非、葡萄牙、英国、以色列等国的主要流行毒株;近期,法国、荷兰等欧洲多国也出现BA.4和BA.5感染者增加的情况。有专家预测,今夏全球可能面临由BA.4或BA.5引起的新一波流行。
国际著名科学杂志《自然》最新的一篇报告中指出,迅速演变的新冠病毒变异体,正使得新冠疫苗更新更加复杂化。当前现有的新冠疫苗,都是基于2019年底出现的SARS-CoV-2原始病毒版本,与时下的奥密克戎变体并不完全匹配。现有疫苗只能提供短暂的保护,却无法有针对性地杀死变异病毒。
西南证券3月的一份研报也显示,现有疫苗基础免疫对于Omicron的有效性较低,各技术路线疫苗针对Omicron的加强免疫对比Delta毒株稍弱但仍能保持较高的中和抗体水平。疫苗仍是控制感染的有效手段。
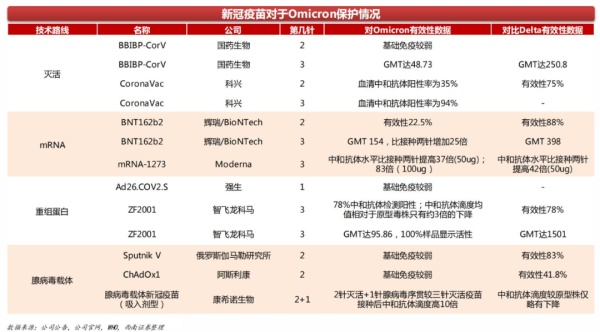 来源:西南证券3月研报
来源:西南证券3月研报
另外,从不同技术路线加强针临床情况来看,目前加强针效果最好的是辉瑞-BioNTech的mRNA疫苗,加强针的有效性达到了95.6%,且入组人数最多。不良反应发生率较低。Moderna采用的桥接试验也证明了加强针的增强抗体水平的作用。
据了解,各大厂商一直在研究更新版本的疫苗。然而,当下研发较多的是针对奥密克戎BA.1变异株。6月28日,辉瑞和 Moderna都有宣布将在今年秋天准备好用于对抗奥密克戎BA.1变异株的疫苗。
但从目前流行的新冠病毒毒株类型来看,针对奥密克戎BA.4和BA.5毒株的新冠疫苗可能更为需要。值得关注的是,虽然VRBPAC首次提议疫苗制造商改进疫苗以应对新的变异株,不过专家组还没有就应该接种针对哪个奥密克戎亚型变异株的疫苗提出建议。
业内推测,若一旦监管要求厂商设计目前占据主导地位的BA.4和BA.5两个Omicron亚型的新冠疫苗,药企们可能需要更多的时间来开发。
值得一提的是,Moderna此前宣布二价Covid-19疫苗加强针,能引起对Omicron亚变体BA.4和BA.5的“有效”免疫反应,其二价加强针候选疫苗包含原始Covid-19疫苗和针对Omicron变体的疫苗成分;另一边,辉瑞也向委员会提交了数据,显示两种针对Omicron的疫苗加强针比其目前的新冠疫苗免疫反应高得多。初步实验室研究表明,这些疫苗可以中和Omicron的BA.4和BA.5。
据相关报道,Moderna和辉瑞都表示要开发出这目前两个主流的Omicron分支,需要等到10月或者11月份左右。可以看到,面对狡猾多变化的奥密克戎毒株,药企们正在吃力追赶。
另一边,今日有消息传出,诺瓦瓦克斯医药新冠疫苗数据表现出广泛的抗体反应,包括对奥密克戎变异株的反应。根据FDA咨询委员会的建议,该公司将准备在今年秋季供应针对奥密克戎变异株的疫苗。更新的奥密克戎疫苗可能在10月至12月之间的某个时间上市。
就在本月初,FDA咨询委员会以21票赞成、0票反对、1票弃权的投票结果,建议批准18岁及以上人群紧急使用诺瓦瓦克斯医药新冠疫苗。
国产疫苗研发竞速
国药中生、科兴、三叶草生物...
最新信息显示,今年2月份以来,我国流行的主要病毒株是奥密克戎BA.2亚分支系列。5月,国内从输入病例中首次检出BA.4和BA.5。近期,境外输入病例中发现的BA.4和BA.5感染者数量呈逐步增加迹象。
在本周二的国务院联防联控机制新闻发布会上,中国国家卫生健康委疾控局副局长、一级巡视员雷正龙表示,奥密克戎BA.2仍然是我国本土疫情的主要病毒株。但是要高度警惕奥密克戎BA.4和BA.5境外输入传播,因为近期在境外输入病例中发现了BA.4和BA.5,并且还有不断增加的迹象。
目前,包括国药集团中国生物、科兴、石药和康希诺、三叶草生物等在内的不少国内药企也在布局针对奥密克戎的疫苗。
2022年4月,有消息称,我国三款针对奥密克戎变异株的疫苗已在香港开展临床试验,预计在不久就能成功推进上市。三款疫苗分别是国药集团中国生物北京生物制品研究所、武汉生物制品研究所研发的BIBP-新型冠状病毒灭活疫苗(奥密克戎变异株)、WIBP-新型冠状病毒灭活疫苗(奥密克戎变异株)两款疫苗,以及科兴研发的克尔来福-Omicron株新型冠状病毒灭活疫苗(Vero细胞)。
资料显示,三款奥株新冠疫苗均获阿联酋阿布扎比卫生部临床试验批件。分析者称,若一切顺利,国内这三款疫苗应在9月份之前可以上市。
2022年4月26日,国药集团中国生物、科兴控股生物的奥密克戎变异株新冠病毒灭活疫苗同日获国家药监局临床批件。
此外,据国金证券统计,4月以来,石药集团和康希诺生物针对变异株开发的mRNA新冠疫苗获得国家药监局批准开展临床试验,安科生物与合肥阿法纳生物达成战略合作,就“新冠奥密克戎等突变株mRNA疫苗”的临床前研究、临床研究、产业化及市场销售等方面开展排他性合作,该项目已经完成药学及药效性研究等,正在进行安全性评价实验,并整理相关临床试验申请资料。
6月27日,三叶草生物公告称,其接种第三剂SCB-2019 (CpG 1018/铝佐剂)同源加强针的个体,对奥密克戎变异株的积极临床进展资料。三叶草生物称,预计于今年第三季度获得关键第三剂加强针组(克尔来福™和Comirnaty®)的安全性和免疫原性数据,第四季度获得第四剂加强针组(克尔来福™)的数据。公司将于2022年下半年完成SCB-2019 (CpG 1018/铝佐剂)在中国国家药监局、欧洲药品管理局和世界卫生组织的注册申请,同时为全球商业化做准备。该消息一出,三叶草生物股价一度暴涨近40%。
6月27日,深圳瑞吉生物科技有限公司宣布,其研发的冻干新型冠状病毒奥密克戎株mRNA疫苗RH109,由下设合资公司——武汉瑞科吉生物科技有限公司,分别在新西兰和菲律宾获得临床批件。本次获批,标志着全球首款冻干型新冠奥密克戎株mRNA疫苗进入临床阶段,具有里程碑意义。
还有多款国产新冠mRNA疫苗也进入临床关键期,瑞科生物新型冠状病毒mRNA疫苗R520A获得菲律宾国家食品药品监督管理局的临床试验批准。R520A为瑞科生物-B附属公司武汉瑞科吉生物针对奥密克戎变异毒株研发的mRNA疫苗;浙江海昶生物的新型冠状病毒mRNA疫苗加强针项目提交的IND申请,也于近日成功获得美国FDA受理。该新冠mRNA疫苗加强针产品将用于预防包括奥米克戎在内的多种变异株感染,适用于前期已接种初始序列新冠疫苗的人群。
另外,近日神州细胞公告称,控股子公司神州细胞工程自主研发的重组新冠病毒Alpha+Beta变异株S三聚体蛋白疫苗(项目代号:SCTV01C)已进行在阿联酋开展的已接种灭活苗人群接种1针SCTV01C加强免疫临床I/II期试验的期中分析并取得积极结果,详细数据拟于近期提交相关科学期刊发表;神州细胞工程还在SCTV01C的基础上进一步开发出4价重组蛋白疫苗产品SCTV01E,其抗原成分增加了最新流行的德尔塔和奥密克戎变异株的重组 S三聚体蛋白抗原。
目前,国内疫情已经进入收尾阶段,未来新冠疫苗是否还需要,又需要多少?是一个未知数。此外,可以看到的一个趋势是,由国内药企研发的新冠疫苗多数都选择了中国局部疫情重灾区或是海外开发,在疫情严峻地区布局,也是一个较好的选择,但是越来越多新冠疫苗厂商参与进来,也带来了诸多不确定性。
来源:新浪医药
版权及免责声明:本网站所有文章除标明原创外,均来自网络。登载本文的目的为传播行业信息,内容仅供参考,如有侵权请联系答魔删除。文章版权归原作者及原出处所有。本网拥有对此声明的最终解释权。


{replyUser1} 回复 {replyUser2}:{content}