7月这几款创新药有望被FDA或欧盟委员会批准 | Bilingual
预计7月,美国FDA、欧盟委员会将分别对1个创新药物的批准做出监管决定。另有2个创新药物已获得CHMP积极意见。
·
·
·
根据PDUFA的预期目标日期和欧洲药品管理局(EMA)人用药品委员会(CHMP)建议的批准日期,预计7月,美国FDA、欧盟委员会将分别对1个创新药物的批准做出监管决定。另有2个创新药物已获得CHMP积极意见,预计将在第三季度(如果审批流程速度较快,有希望在7月)迎来审批决定。
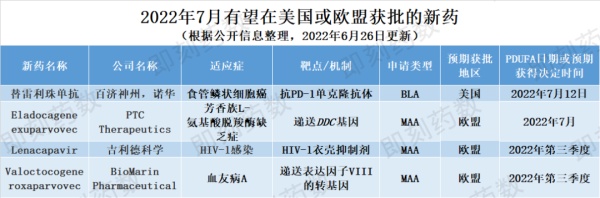
Tislelizumab是一种靶向PD-1的人源化IgG4单克隆抗体,正在寻求美国FDA批准用于治疗不可切除的、复发性局部晚期或转移性食管鳞状细胞癌(ESCC)。替雷利珠单抗已在中国获批九个适应症,包括经典霍奇金淋巴瘤、肝细胞癌、转移性尿路上皮癌等。在美国,基于3期临床试验的积极数据,FDA于2021年9月接收了百济神州代表诺华公司提交的生物制品许可申请(BLA),PDUFA目标日期设定为2022年7月12日。ESCC是最常见的食管癌类型,也是全球癌症相关死亡的第六大原因,三分之二的ESCC患者在诊断时疾病已进行至晚期或转移性阶段。迄今为止这种疾病的治疗选择有限,转移性ESCC的平均5年生存率仅为5%。如果在美国获得批准,这将为这种严重疾病提供一种新的治疗选择。新药名称:Eladocagene exuparvovec预计7月迎来欧盟委员会(EC)批准决定的候选治疗药物之一是PTC Therapeutics(PTC)的eladocagene exuparvovec(Upstaza),这是一种基于重组腺相关病毒血清型2(AAV2)的基因疗法,通过将功能性DDC基因直接传递到壳核中,一次性治疗芳香族L-氨基酸脱羧酶缺乏症(AADC缺乏症)。2022年5月,CHMP给出了建议批准的积极意见。AADC缺乏症是一种致命的罕见神经系统疾病,在没有有效治疗的情况下会导致严重残疾。该公司预计,在CHMP的建议后约2个月,欧盟将于7月批准eladocagene exuparvovec在特殊情况下的上市许可。如果获得批准,这将是治疗18个月以上AADC缺乏症患者的潜在首个改变疾病进程的疗法,也将是潜在首个直接输注到大脑中的获批基因疗法。公司名称:吉利德科学(Gilead Sciences)Lenacapavir是吉利德科学正在开发的潜在“first-in-class”HIV-1衣壳抑制剂,作为一种6个月缓释的皮下注射制剂,与其他抗逆转录病毒药物联合使用,它可以干扰HIV病毒衣壳蛋白的组装和拆卸,在HIV-1生命周期的多个阶段发挥作用。2022年6月,CHMP给出积极意见,建议授予该药物在欧盟的上市许可。MAA申请得到2/3期CAPELLA试验的积极数据的支持,吉利德预计EC将在今年第三季度做出决定。如果获批,lenacapavir可以为这个目前无法治愈且治疗选择有限的未满足需求群体提供一种新的长效治疗选择。新药名称:Valoctocogene roxaparvovec公司名称:BioMarin Pharmaceutical另一种在欧盟等待监管批准的候选药物是BioMarin的valoctocogene roxaparvovec(Roctavian),这是一种基于腺相关病毒血清型5(AAV5)的基因疗法,用于治疗严重的血友病A。BioMarin于2021年6月重新提交MAA,并补充了3期GENEr8-1试验的一年安全性和有效性数据。该疗法获得了加速评估,CHMP于2022年6月给出积极的意见,推荐valoctocogene roxaparvovec有条件上市。BioMarin预计EC将在2022年第三季度做出最终决定。据估计,欧洲、中东和非洲有超过2万名成年人受到严重血友病A的影响,该患者群体的护理标准是长期终身注射治疗。一旦获得批准,Roctavian将成为欧洲潜在的首个治疗血友病A的基因疗法,并有可能成为严重血友病A的护理治疗标准。

来源:药明康德
版权及免责声明:本网站所有文章除标明原创外,均来自网络。登载本文的目的为传播行业信息,内容仅供参考,如有侵权请联系答魔删除。文章版权归原作者及原出处所有。本网拥有对此声明的最终解释权。










{replyUser1} 回复 {replyUser2}:{content}