破解“血之诅咒”,基因疗法未来1-10年都有哪些重要进展?
内容概要
2022年临床积极进展
今年有8款血液疾病基因疗法获得临床积极进展
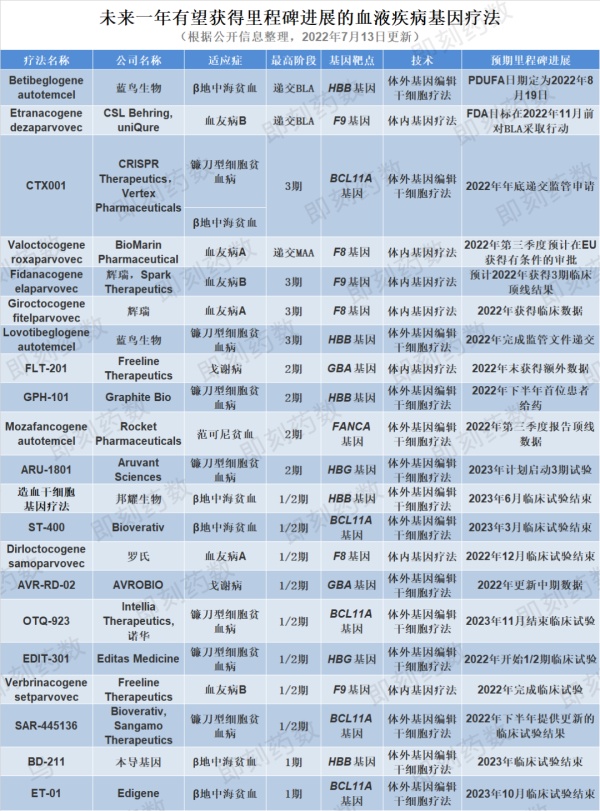
未来一年有22款血液疾病基因疗法有望获得里程碑进展(获批、递交监管申请或取得临床进展),其中5款疗法有望获批
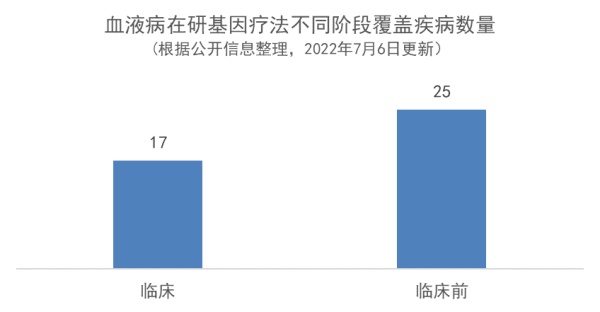
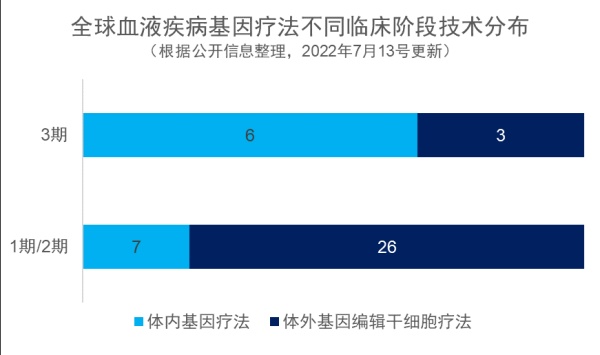
血液疾病患者受益群体扩大:中性粒细胞减少症、阵发性睡眠性血红蛋白尿等疾病为临床前阶段相对于临床阶段新增适应症,未来这些疾病患者群体有望使用基因疗法进行治疗 更多体外基因疗法涌现:临床阶段的体外基因编辑的干细胞疗法数量上远超体内基因疗法,体内基因疗法在3期比例较高(67%) 基因疗法延长有效治疗时间:尽管基因疗法理论上有望一次治疗,但实际效果是否会随着时间推移而消失仍有待验证。在公布了临床随访结果的20多种临床阶段血液病基因疗法中,绝大多数疗法的随访有效期达到了0.5到2年,有望极大改善患者治疗体验
2022年临床积极进展
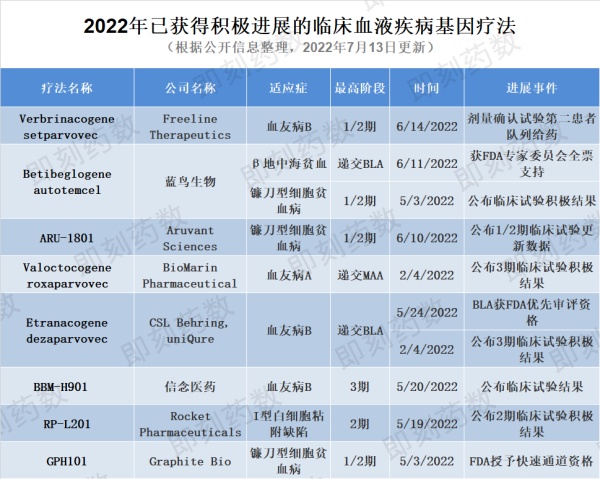
▲2022年已获得积极进展的临床血液疾病基因疗法(图片来源:药明康德内容团队制图)
未来一年内重要里程碑
未来一年有22款血液疾病基因疗法有望发生里程碑进展(获批、递交监管申请或取得临床进展),其中5款疗法有望获批。
疗法名称:betibeglogene autotemcel
公司名称:蓝鸟生物
适应症:β地中海贫血
Betibeglogene autotemcel(beti-cel)是一种造血干细胞体外基因疗法,用于治疗需要接受常规血红细胞输注的β地中海贫血患者。该疗法从患者体内分离出造血干细胞,并利用病毒载体引入经过修饰、能行使正常功能的β球蛋白基因,是一种潜在的一次性治疗基因疗法。目前该生物制品许可申请(BLA)申请正在接受FDA审评,PDUFA目标日期设定为2022年8月19日。目前该疗法已获FDA优先审评资格,并在今年6月份获得FDA专家委员会全票支持。如果获得FDA的批准,预计该疗法会成为潜在的美国首个针对β地中海贫血患者的慢病毒载体基因疗法。
疗法名称:etranacogene dezaparvovec
公司名称:CSL Behring,uniQure
适应症:血友病B
Etranacogene dezaparvovec由CSL Behring与uniQure合作开发,旨在使用腺相关病毒5(AAV5)载体递送表达FIX Padua变体的基因,用于治疗中重度至重度血友病B。该疗法已在其3期试验中证明了安全性并达到了主要和次要疗效终点。今年5月,CSL Behring宣布,美国FDA已接受该公司为在研基因疗法etranacogene dezaparvovec递交的BLA,用于治疗血友病B成人患者。FDA同时授予这一BLA优先审评资格。获得优先审评资格后,FDA将在6个月内对其BLA申请采取行动。如果获得批准,etranacogene dezaparvovec可能是潜在的第一个为血友病B患者提供持久、功能性治疗益处的基因疗法。
疗法名称:CTX001
公司名称:CRISPR Therapeutics,Vertex Pharmaceuticals
适应症:镰刀型细胞贫血病
CRISPR Therapeutics与Vertex合作开发的基因编辑疗法CTX001是一款在研的自体CRISPR/Cas9基因编辑疗法。通过在体外对患者的造血干细胞进行改造,使红细胞中产生高水平的胎儿血红蛋白。今年6月,两家公司公布了CTX001的最新临床试验结果,从总计75名患者中获得的结果显示,CTX001具有一次治疗,提供功能性治愈的潜力。两家公司同时表示,临床试验已经完成所有患者注册,试验进度支持年底前递交监管申请。
疗法名称:valoctocogene roxaparvovec
公司名称:BioMarin Pharmaceutical
适应症:血友病A
BioMarin的valoctocogene roxaparvovec是一种基于腺相关病毒血清型5(AAV5)的基因疗法,用于治疗严重的血友病A。BioMarin于2021年6月重新提交上市许可申请(MAA),并补充了3期GENEr8-1试验的一年安全性和有效性数据。该疗法获得了加速评估,CHMP于2022年6月给出积极的意见,推荐valoctocogene roxaparvovec有条件上市。BioMarin预计EC将在2022年第三季度做出最终决定。据估计,欧洲、中东和非洲有超过2万名成年人受到严重血友病A的影响,该患者群体的护理标准是长期终身注射治疗。一旦获得批准,它将成为欧洲潜在的首个治疗血友病A的基因疗法,并有可能成为严重血友病A的护理治疗标准。
疗法名称:fidanacogene elaparvovec
公司名称:辉瑞(Pfizer),Sparks Therapeutics
适应症:血友病B
辉瑞与Sparks Therapeutics共同开发的fidanacogene elaparvovec是一种静脉内给药的基因疗法。通过腺相关病毒(AAV)载体递送,在患者的肝细胞中提供编码因子IX的基因副本。通过这种方式,该疗法有助于在患有血友病B患者血液中维持持续的IX因子水平。2016年9月,SPK-9001获得了FDA突破性疗法认定。目前该疗法处于3期临床试验中。
其余有望发生临床开发里程碑进展的血液疾病基因疗法请见下图。
未来十年潜在发展方向
1
适应症患者群体扩大
2
更多体外基因疗法涌现
3
基因疗法延长有效治疗时间
来源:药明康德
版权及免责声明:本网站所有文章除标明原创外,均来自网络。登载本文的目的为传播行业信息,内容仅供参考,如有侵权请联系答魔删除。文章版权归原作者及原出处所有。本网拥有对此声明的最终解释权。


{replyUser1} 回复 {replyUser2}:{content}