多款创新疗法折戟后,阿尔茨海默病2022下半年希望在何?
AD是一种进行性神经退行性疾病,临床上以记忆障碍、失语、失用、失认、视空间技能损害、执行功能障碍以及人格和行为改变等全面性痴呆表现为特征,病因迄今未明。
过去20多年里,FDA仅批准了5款AD的治疗药物,国内外获批药物总数不足20种。这片潜力巨大的蓝海吸引着众多药企争相涌入,但从目前的情况来看,并不乐观。
随着全球患病率的迅速增加,AD已被国际医学界认定为人类的主要健康威胁。为了不断提高大家的关注,国际医学界将6月定为阿尔茨海默病和大脑意识月。然而,上个月对于AD领域来说不太好过,包括罗氏、Athira、Acadia和渤健在内的几家公司宣布,针对AD不同阶段开发的药物临床试验结果不佳。
但这一赛道不乏希望。今年下半年,Nuplazid、lecanemab等备受关注的产品将接受监管机构的审批。


6月16日,罗氏宣布其抗淀粉样蛋白-β单克隆抗体(mAb)Crenezumab在II期试验(NCT01998841)中失败。该研究旨在评估Crenezumab在携带导致早发性AD的特定基因突变的认知未受损人群中,减缓或预防AD的潜力。遗憾的是,Crenezumab最终未能达到评估认知能力或情景记忆功能变化率的任何一个共同主要终点。
尽管在共同主要终点、多个次要终点和探索性终点中观察到有利于Crenezumab的小数值差异,但这些差异无统计学意义。罗氏表示,将在8月的阿尔茨海默病协会国际会议上公布初步数据。罗氏是会放弃Crenezumab,还是会转变药物的发展方向,或许能从这些数据中得以一窥。
罗氏另一款皮下注射Aβ抗体Gantenerumab可能会成为将来的重点。去年,FDA授予Gantenerumab突破性疗法认定,罗氏曾表示希望尽快向FDA递交上市申请,然而渤健遭受的一系列商业化挫折,让罗氏有些迟疑。
罗氏正在关键III期临床试验GRADUATE1/2研究中评估Gantenerumab针对早期AD的疗效,该项数据预计将在2022年第四季度披露。作为一款皮下注射制剂,Gantenerumab具有居家给药的潜力,相较于其他同类产品更具优势。


Nuplazid(pimavanserin)是一种选择性5-羟色胺反向激动剂和拮抗剂,于2016年获批,成为首款用于治疗某些帕金森病患者所出现的精神错乱相关幻觉和妄想的药物。
今年6月17日,FDA精神药理学药物咨询委员会以9:3的票数,反对Acadia的Nuplazid片剂用于治疗与AD精神错乱相关的幻觉和妄想的补充新药申请。委员会认为,现有数据无法支持Nuplazid在相关适应症中具有明确疗效。
虽然FDA不必遵循专家组的建议,但鉴于去年4月,FDA拒绝批准Nuplazid治疗痴呆相关的精神病患者的幻觉和妄想症(AD作为其中一个亚组),FDA似乎不太可能批准该药物。
目前,FDA已将该疗法的补充新药申请推迟至8月4日。值得注意的是,Nuplazid的销售额在今年第一季度达到了1.155亿美元,同比增长8%。

去年6月,FDA宣布批准渤健/卫材Aβ(β淀粉样蛋白)抗体Aduhelm用于治疗早期AD患者的BLA。Aduhelm被认为是自2003年以来FDA批准的首个治疗AD的新药。
不过,此举引发公众对该药生产过程、疗效和年度成本的诸多质疑和忧虑,更有三位知名教授从FDA咨询委员会离职,以抗议FDA批准Aduhelm上市。
今年4月,CMS宣布,美国联邦医疗保险计划(Medicare)将Aduhelm的覆盖范围局限于参与随机对照临床试验的患者。6月21日,ClinicalTrials.gov发布的最新消息称,渤健已经终止了观察性ICAREAD试验,该试验旨在收集Aduhelm在美国使用的真实数据。
由于临床试验的患者数量有限,Aduhelm的医保限制实际上意味着其商业前景的终结。渤健2022年第一季度财报显示,Aduhelm第一季度的销售额仅为280万美元。而此前,曾有多位分析师预测,Aduhelm在上市后第一个季度的销售额可能会突破1079万美元。
渤健是否有机会获得更广泛的Aduhelm覆盖范围,取决于目前的IV期ENVISION试验,这是为了获得加速批准而设计的验证性研究,但还需数年时间才能完成。
不过目前,渤健已将重点转移到其第二个抗淀粉样β抗体lecanemab。2014年3月,卫材和渤健就lecanemab签订了联合开发和商业化协议,卫材拥有最终决策权。5月,卫材完成了向FDA滚动提交lecanemab的申请,寻求基于生物标志物数据的加速批准。
此外,lecanemab已在去年6月获FDA突破性疗法认定。根据此前披露的临床试验数据,lecanemab能够选择性结合以消除可溶性、有毒的Aβ聚集体(原纤维),这些聚集体被认为推动AD中的神经退行性过程。
该药物的确证性试验Clarity AD的数据预计于今年秋季公布,届时将会得出其是否能减缓AD临床症状的关键结果。渤健和卫材期望在2022财年向FDA递交申请,以实现lecanemab的完全批准。

6月,Athira Pharma宣布其用于治疗AD的Fosgonimeton(ATH-1017)在II期ACT-AD试验中未能达到主要终点。
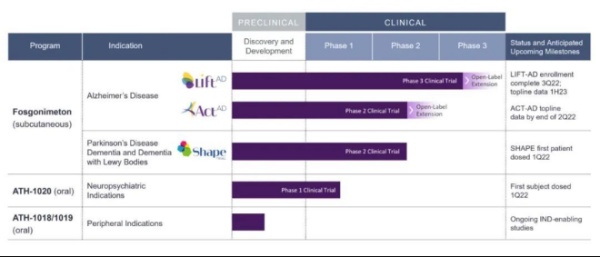
Fosgonimeton(ATH-1017)是一种小分子,旨在增强肝细胞生长因子(HGF)及其受体MET的活性,以影响神经退行性变和脑组织再生。在神经退行性变的情况下,HGF/MET受体系统的功能可能在大脑中受损。
ACT-AD试验为期26周,用于评估Fosgonimeton在治疗轻度至中度AD中的疗效。该研究主要终点是事件相关电位(ERP)P300潜伏期的变化(一种功能性、客观的工作记忆处理速度测量方法),次要终点包括认知测量(ADAS-COG11)、临床全球变化印象(ADCS CGIC)和日常生活工具活动(ADCS-ADL23)。此外,研究还将评估Fosgonimeton的血浆药代动力学。
尽管此次试验未达到研究主要终点,但Athira指出,与安慰剂相比,使用Fosgonimeton单药治疗的患者(与联合使用标准的乙酰胆碱酯酶抑制剂)预先指定的亚组分析表明,ERP P300潜伏期和AD评定量表-认知量分表均有所改善。
目前,Athira已经启动了一项轻中度AD的Fosgonimeton III期临床试验(NCT04488419),但在这项规模更大的试验中,Fosgonimeton作为单药治疗是否会显示出疗效,还有待观察。如果试验成功,GlobalData预计到2030年,该药在美国的销售额将达到8.24亿美元。
除AD外,Fosgonimeton也有望治疗更广泛的痴呆症人群,包括帕金森痴呆症和路易体痴呆症。

AD临床试验的成功率史上最低,开发治疗AD的新药可以说是举步维艰。尽管如此,AD的未来仍有希望。罗氏、卫材/渤健和礼来预计将在今年末或明年初公布各自AD药物III期临床试验结果。
此外,大冢制药和灵北制药于6月27日宣布,在III期试验(NCT03548584)中,与安慰剂相比,brexpiprazole显著降低了AD痴呆患者的躁动。
2015年,brexpiprazole获FDA批准用于治疗成人精神分裂症与重度抑郁症的辅助治疗。基于上述试验的积极结果,大冢和灵北制药计划在今年晚些时候向FDA提交一份补充新药申请。GlobalData预计,到2030年,brexpiprazole在美国的销售额将达到4.15亿美元。
来源:同写意


{replyUser1} 回复 {replyUser2}:{content}