mRNA赛道遇冷,能否再度火热?——浅谈mRNA疗法的临床优势与挑战
新冠疫情“催熟”了mRNA技术,但在新冠疫情之后,作为新冠的防控利器,新冠疫苗透支了整个疫苗行业近三年的关注和投资市场景气度,国内现在的mRNA疫苗市场并不好过。据统计,国内在做mRNA疫苗的企业,近来并未获得资本的青睐,估值大多都在2020-2021这段时间达到巅峰值,然后一路下跌,2021年至今mRNA疗法市场整体处于“坐冷板凳”的氛围。
因为FDA的优先放行、深厚的技术储备和mRNA疫苗的唯一性,mRNA疫苗在美国接连缔造商业传奇,在中国却一言难尽。2022年,中国的mRNA疫苗似乎正走进一个尴尬的境地。截至2022年8月15日,当国外药企都担忧新冠疫苗市场饱和时,中国mRNA领域打头阵的新冠疫苗却还未能获批。抛去政策等外部环境因素,根本原因是这批2019年前后才刚成立的中国mRNA疫苗企业,技术储备远不如十多年前就成立的Moderna和BioNTech。
国内现在最需要做的或许就是改革mRNA技术,突破技术壁垒。如今已有大量的国内企业涌入这个赛道,随着技术的不断提升,mRNA技术的广大应用前景或能使得mRNA赛道再度令人瞩目。
mRNA疗法兼具抗原呈递与自佐剂的作用
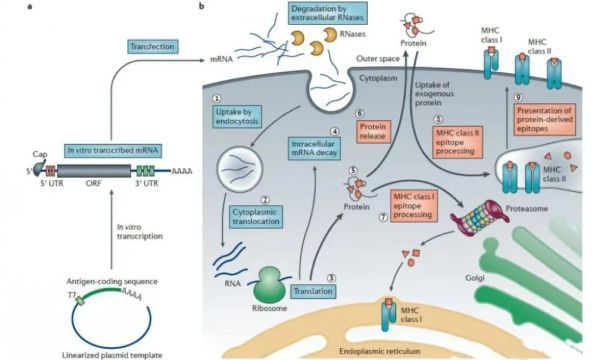
当体外转录的mRNA递送到人体后,兼具着抗原呈递和自佐剂两方面的作用。首先,胞质内少量mRNA就可以实现抗原呈递到CTL细胞,而蛋白质只能依赖效率较低的交联提呈途径;机体通过mRNA翻译可持续地获得抗原,在抗体广度和亲和力方面显著优于蛋白质相关疫苗,带来更持久的保护。此外,mRNA相较蛋白质可递呈抗原种类更丰富,mRNA能编码全长蛋白质,因此可避免病人MHC半抗原限制。同时,通过串联结构设计可以将多种抗原表型组装在一条mRNA链中。其次就是自佐剂的作用,内体中的mRNA会被多种模式识别受体(PRR)识别,促进I型干扰素(IFN-I)和其他促炎细胞因子(如IL-6和TNF-α)的产生。
相比于各类传统药物,mRNA成药更加灵活
小分子化药通过与靶点蛋白结合发挥治疗作用,但可成药的靶点蛋白数量有限,靶向性差因此无法从机制上治疗疾病。在小分子药物之后,以抗体药物为主的生物药逐渐出现,与小分子化药相比,抗体药物可作用的靶点蛋白种类更多,且可通过蛋白质工程技术提升其亲和性降低毒性等。
但是抗体类药物拥有分子结构更加复杂、生产成本更高、通常需通过注射给药等劣势,并且抗体药物通常只能与细胞膜表面或细胞外的蛋白质发挥作用,使得其应用受到一定限制。小分子和抗体药物的发现和优化过程中,对活性、PKPD等性质的优化均需要对结构做改动,需要花费大量的工作。
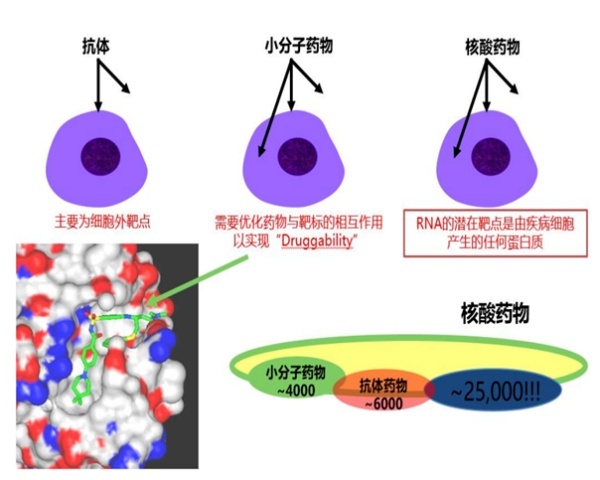
相比之下,核酸类药物拥有明显的优势。核酸类药物可基于碱基互补原理对表达相关蛋白质的基因进行调节,如ASO、siRNA、miRNA、saRNA等,而非与靶点蛋白质进行结合,且通过合适的递送系统可使其进入细胞内发挥作用,而且对胞内外和细胞膜蛋白均可发挥调节作用。
同时,多数核酸类药物的作用基础是碱基互补配对原则,只需知道靶基因的碱基序列,核酸药物的序列设计就十分容易,化学修饰和递送系统的设计与序列的设计也是相对独立的,因此可直接快速翻译成蛋白质,半衰期短、代谢产物天然,没有持续和积累性,研发周期快。
稳定性和递送效率
mRNA的稳定性和递送效率一直是限制因素,细胞外存在大量RNase可以将大部分进入体内的mRNA降解,只有小部分mRNA可以逃脱RNase进入细胞内。因此,mRNA要想成药,需要有一定的递送系统包被。进入细胞内的mRNA翻译效率也是另一个制约其成药性的问题。
mRNA代谢路径与其进入细胞的方式有关,传统胞饮或者脂嗜的内吞路径与内吞体代谢相关,因此如何提升内吞体逃逸效率是传统mRNA提送一大难题。提高mRNA稳定性及翻译效率是mRNA走向临床应用必须要跨越的障碍。目前,提高mRNA的稳定性和翻译效率,主要通过mRNA结构化学优化以及递送系统的优化。
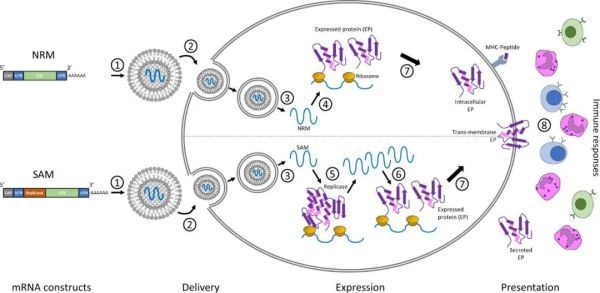
由于mRNA药物半衰期有限,无法长期表达等缺点,外源核酸药物要想进入体内发挥作用,应考虑如何存留足够时间以准确靶向到病变部位,同时避免损伤正常细胞,归根结底是研发出高效安全的药物递送系统,首先需要避免被快速清除并延长半衰期。
解决方法
➤较好的解决方法为通过PEG化降低肾脏清除速率,或者制成纳米粒结构(通常在10–200nm),可使其高于肾脏清除的分子量界限。此外核苷酸的化学修饰可降低核酸药物对核酸酶的敏感性,制成纳米粒结构可以避免核酸药物在递送过程中与核酸酶直接接触。
对递送系统的修饰可以增强核酸药物在靶组织的摄取效率,比如纳米粒结构可使得提高核酸药物在肝脏,脾脏或肿瘤等组织中的渗透性,提高与靶细胞结合和细胞摄取效率。尽管化学修饰可以改善核酸药物的稳定性和免疫原性,核酸药物需进入细胞内才可以发挥作用,由于核酸药物分子量较大且通常带负电荷,因此被细胞摄取的效率和内吞体逃逸的效率比较低,因此需借助递送系统的力量。
脂质类是目前核酸药物中研究应用最多的递送系统之一,且已经有使用脂质纳米颗粒递送系统的核酸药物获批,根据其性质和结构的不同其可以分为脂质体、脂质纳米颗粒(LNP,lipid nanoparticle)等,目前研究中用的较多的包括含有可离子化脂质的LNP。
➤为了优化mRNA的效率,科学家们探索了对mRNA结构的各种化学修饰,包括修改5'-帽,多聚腺苷酸(A)尾部,5'-和3'-UTR以及编码区域。mRNA帽由7-甲基鸟嘌呤(m7G)组成,是在转录过程中通过5',5'-三磷酸酯桥连接到初次转录后的RNA核苷酸中。它不仅通过与翻译起始因子4E(EIF4E)结合参与翻译过程,也与DCP1 / DCP2结合调节mRNA的降解。
报道最多的帽盖类似物是核糖内修饰的抗反向帽盖类似物(ARCA)m7G的部分。ARCA加帽的mRNA可防止在mRNA合成过程中错误地结合帽,因此表现出卓越的翻译效率。
2021年,Jacek Jemielity等合成了一类新的帽类似物,称为2S类似物,其结合了二硫代二磷酸修饰,ARCA和延伸的多磷酸盐链。他们发现这种2S类似物提高了其在人未成熟树突状细胞中的翻译水平,并优于之前发表的用于临床试验的磷酸盐修饰的帽类似物。
最近,Moderna公司的研究人员观察到mRNA二级结构可以通过改变mRNA翻译的半衰期来调节蛋白的表达,并且修饰的核苷酸可以稳定mRNA空间结构以实现蛋白的高表达水平。计算机辅助也被用于设计产生或多或少所需蛋白质的mRNA序列。迄今为止,该技术已成功用于基于mRNA的疗法,例如非病毒蛋白的表达和传染病疫苗的开发。
总的来说,5'-帽,3'-多聚(A)尾巴,5'-和3’-UTR和编码区域都可以作为修饰靶标。为了获得最好的mRNA的治疗效率,有必要针对特定应用做出优化组合。不过因为像Moderna、BioNTech这些mRNA龙头企业已经申请了各项mRNA技术专利,形成了超高的技术壁垒,其他企业要想在技术上有所突破会比较困难。
mRNA的免疫原性
IVT mRNA的一个重要问题是其免疫原性,因为外源性RNA将被视为病毒感染的信号。非免疫细胞识别RNA通过视黄酸诱导基因I(RIG-I)受体,然后触发先天免疫反应。免疫细胞可以被IVT mRNA激活并诱导通过Toll样受体引起的炎症。富含U的RNA序列是已知的Toll样受体的有效激活剂。因此,可以通过降低U的含量来解决免疫原性问题。
解决方法
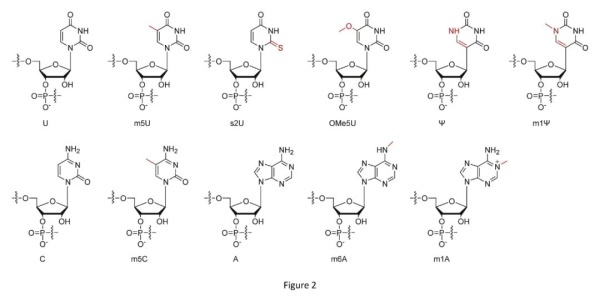
迄今为止,可以选择几种核苷酸化学修饰策略以降低免疫原性而不影响其翻译特性。例如,将天然腺苷替换为N1-甲基腺苷(m1A)或N6-甲基腺苷(m6A)。替换天然胞嘧啶核苷为5-甲基胞嘧啶核苷(m5C);并将天然尿苷替换为5-甲基尿苷(m5U),2-硫尿苷(s2U),5-甲氧基尿苷(5moU),假尿苷(ψ)或N1-甲基伪杜鹃碱(m1ψ)。
其中,m5C和ψ备受关注,因为无论是体内还是体外都表明,它们降低mRNA的免疫原性同时也提高了翻译效率。同时研究者发现增加聚(A)尾巴的长度并减少U含量或将其隐藏在序列中会产生低的免疫原性。
除了修饰核苷酸并添加多聚(A)尾巴以外,优化富含GC的密码子并使U含量最小化是另一种消除RNA免疫原性的有效方法。CureVac和Acuitas Therapeutics开发了一种无需对mRNA进行任何化学修饰的序列工程方法。他们通过给每一个氨基酸选择富含GC密码子设计了EPO的mRNA序列,并使用LNP对猪全身给药。结果表明EPO蛋白的表达导致积极的生理反应而没有可检测的免疫原性。但是,应注意GC含量不是越多越好,因为过量的GC含量不利于蛋白质表达。
体外转录后,生产mRNA需要一系列纯化过程包括浓缩,沉淀,萃取和色谱法。精密的工艺技术,例如阴离子交换色谱法,大小排阻色谱柱,高效液相色谱(HPLC)和亲和力色谱法去除双链RNA和转录本的片段。这些纯化程序对消除免疫原性是必须的。
据报道经HPLC纯化后具有ψ修饰的mRNA没有了免疫原性并且蛋白质翻译效率显著提高。在一个代表性的例子中,Pardi等将编码广泛中和HIV-1抗体VRC01的轻链和重链mRNA进行m1ψ修饰和HPLC纯化,并将其包裹在LNPs里。结果发现,全身给药后,mRNA-LNPs很快在小鼠中转为功能性抗体。单次注射mRNA-LNP完全保护小鼠免受HIV-1感染。
2020年由于新型冠状病毒肺炎疫情爆发,mRNA疫苗的研发及产业化进程被大大提速,但也存在一定程度的“透支”,短期内难以再看到这一赛道的昔日荣光。但是,由于mRNA技术天生携带着不可否认的硬核优势,因此我们有充分的理由相信,经过一段时间的技术锤炼后,在不久的将来一定会有更丰富的mRNA产品进入市场。
目前来看,国内mRNA企业整体实力要赶上走在前列的国际Bigpharma难度还很大。但仍有大量企业布局了mRNA疗法,包括预防性和治疗性疫苗以及治疗性药物,在传染病领域,如流感、呼吸道合胞病毒(RSV)、HIV等感染性疾病的预防,还有蛋白替代疗法和抗肿瘤领域,均有不少mRNA产品已经被推进至临床研究阶段。
相信在未来,我们会看到随着国内对mRNA技术科学认知的进一步深入,将基于该技术的特性,结合其作用机制及特定的风险,能继续推进mRNA技术的变革。国内mRNA疗法有着可期的巨大市场前景,我们可以期待逐渐冷下来的国内mRNA市场未来能再度迎来热度。对mRNA技术潜力的挖掘,我们或许才刚开始不久。
来源:Senna 星耀研究院


{replyUser1} 回复 {replyUser2}:{content}