解读前沿小分子技术PROTAC和分子胶,蛋白降解剂研发突破就在前方
继PD-1、CAR-T之后,全球掀起了蛋白降解靶向嵌合体(Proteolysis targeting chimera,PROTAC)技术的研究热潮。很多无法用小分子调控或抗体无法到达的靶点可以采用PROTAC技术进行调控,为癌症治疗提供了一种潜力巨大的新思路。蛋白降解技术以其在突破不可成药靶点、克服现有靶点耐药突变等方面的巨大潜力和优势,吸引了众多科研机构和研发药企的大力投入,也获得了资本的青睐,成为小分子药物突围的一个风口。通常,细胞内的蛋白质通过泛素-蛋白酶体系统(Ubiquitin-Proteasome System,UPS)和自噬-溶酶体(Autophagy-lysosome)两条途径进行降解。基于泛素-蛋白酶体途径设计的蛋白降解剂包括了蛋白降解靶向嵌合体(Proteolysis targeting chimera,PROTAC)和分子胶(Molecular Glues)。
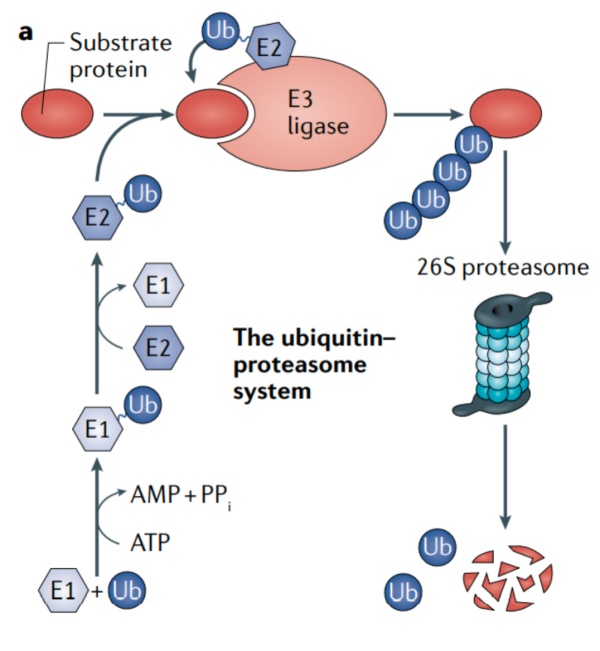
泛素化是一种多功能的蛋白质翻译后修饰过程,是由3种酶催化的级联反应,泛素分子首先通过与E1泛素活化酶连接使其激活,然后转移到E2泛素结合酶中,最终通过E3连接酶将活化的泛素分子转移至靶蛋白,从而使靶蛋白形成多聚泛素链,多聚泛素化之后的靶蛋白会被26S蛋白酶体特异性识别并被降解。
01
PROTAC概述

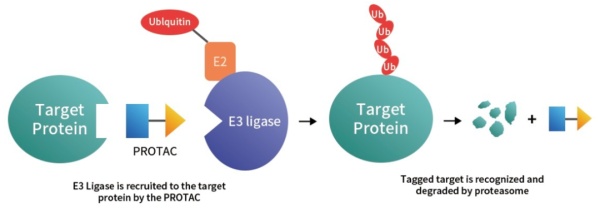
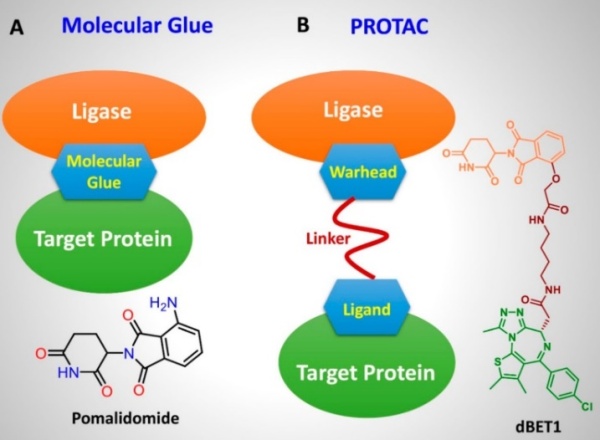
PROTAC诱导蛋白降解的作用机制如下图所示:PROTAC在进入细胞后,其结构中的靶蛋白配体(POI ligand)特异性地与靶蛋白(POI)结合,另一端的E3连接酶配体(E3 ligand)与E3连接酶(E3 ligase)结合,从而形成POI-PROTAC-E3 ligase的三元复合物,然后E3连接酶介导泛素结合酶E2,将三元复合物中的靶蛋白POI泛素化,三元复合物解离后,被多泛素化标记的靶蛋白会被输送到蛋白酶体(proteasome)中进行降解,从而选择性地降低靶蛋白水平。此过程无需靶蛋白配体长时间占据结合位点,只需要三元复合物短暂的形成便可完成靶蛋白的泛素化,贴有多泛素化标签的靶蛋白能够被蛋白酶体识别并降解,且PROTAC在细胞内可多次循环发挥作用。
靶蛋白配体(POI ligand)
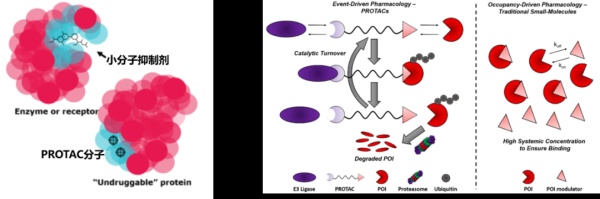
传统的小分子通过直接作用于靶蛋白表面具有一定深度的蛋白结合口袋(binding pocket)来调节蛋白功能。据统计,人类超过80%的蛋白属于“不可成药”靶点。通常“不可成药”靶点蛋白表面平坦光滑,传统小分子难以寻找到有效的结合位点(binding site)。PROTAC不直接抑制靶蛋白的功能活性,因此不需要与靶蛋白长时间和高强度的结合,利用PROTAC技术,理论上只要靶蛋白上有裂缝、缺口等可以短暂“着力”的地方就行,因此可以靶向传统难以成药的蛋白。虽然PROTAC技术理论上能靶向许多以前被认为是“不可成药”的靶点,但目前突破点还是会首选一些经过验证的靶点,比如以研究比较深入且具有很好潜力的抑制剂作为POI配体的设计源头。
E3连接酶
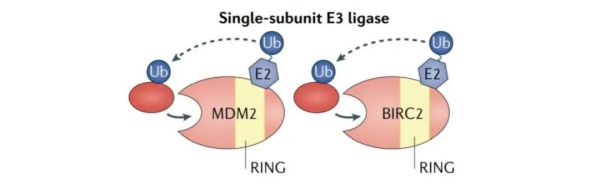
E3连接酶家族可分为三种类型:HECT型、RING型和RBR型。到目前为止,所有的PROTACs都需要募集一个RING型的E3连接酶,因此,此处只讨论RING型的E3连接酶。RING型是指E3连接酶的结构中含有RING finger(环指),根据RING finger的所属不同,又可分为单亚基的E3连接酶(E3连接酶为单个亚基,且该亚基中含有RING finger)和多亚基的E3连接酶复合体(E3连接酶为多个亚基组合形成,其中含有带有RING finger的亚基,如ROC1等)。
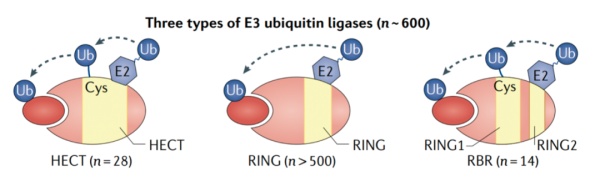
通常,单亚基的E3连接酶只能泛素化极少底物。例如,单亚基E3连接酶MDM2主要调控p53,而BIRC2(也称cIAP1)主要调控CRABP2和DDIT3 (也称CHOP)。
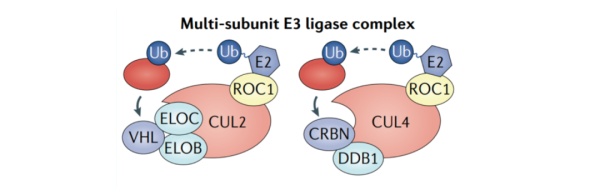
多亚基的E3连接酶复合体则可以靶向多种底物蛋白,这种高度可塑性是通过复合体中每个单独亚基固有的灵活性来实现的。Cullin蛋白家族可以通过结合一个小的RING蛋白,或RING box蛋白(ROC1或ROC2),组装成多达300多种不同类型的多亚基的Cullin-RING E3连接酶复合体(CRLs)。目前,最常用的两个E3连接酶复合体就是CRL亚家族的成员,即CRL2-VHL和CRL4-CRBN。
E3连接酶配体(E3 lgand)
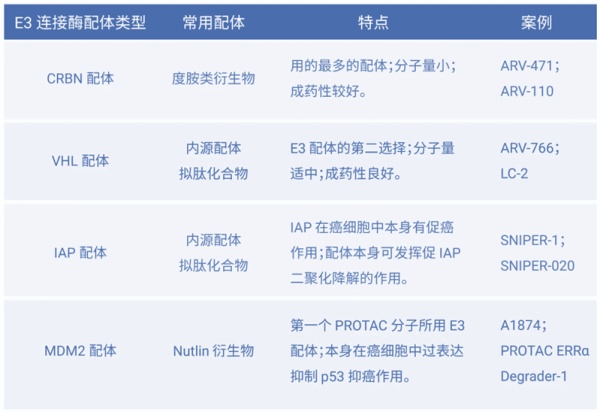
目前人体内已被发现的E3连接酶有600多种,但PROTAC中常用的E3连接酶只有MDM2、cIAP1、VHL和CRBN。此外还有 DCF15、RNF114、DCAF16等仅有少数配体报导的E3连接酶。单亚基的E3连接酶只能泛素化极少底物,而多亚基的E3连接酶复合体则可以靶向多种底物蛋白,具有高度可塑性。因此,在目前的研究中,最常用的E3连接酶主要是VHL和CRBN。目前进入临床的PROTAC,用到的主要是VHL和CRBN。目前已经公布结构的分子中,Arvinas的ARV-110,ARV-471都选择靶向CRBN;Dialectic公司的DT-2216则选择靶向VHL。
连接链(Linker)
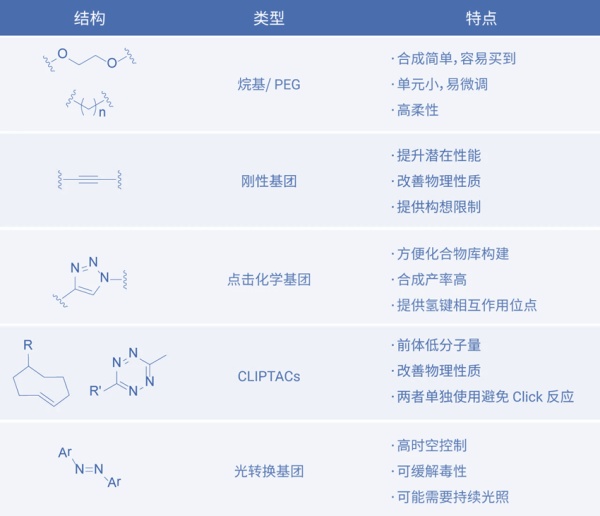
Linker是连接E3连接酶配体与靶蛋白配体的连接单元,对于PROTAC分子的成药性非常重要。链长是Linker最重要的参数,链长过短会因空间碰撞而阻碍三元配合物形成,链长过长则会带来结合熵增加。目前报道的PROTAC分子中,Linker的选择以聚乙二醇和烷基链为主,分别占54%和31%。常用酯化、酰胺化、Click反应等构建,后期改造则是在此基础上,通过改变链长、引入芳基增加疏水性及刚性、增加一条连接链限制分子扭转、利用光转换基团事先屏蔽活性位点等方法来提高分子的总体性能。
02
分子胶概述
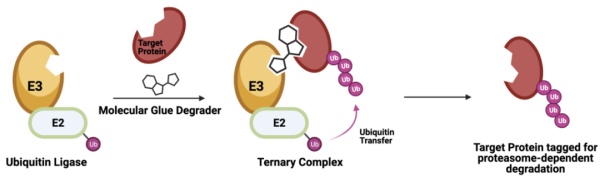
与PROTAC不同的是,分子胶对E3泛素连接酶和靶蛋白具有双配体结构特征,兼具同两个蛋白结合的功能,促进两个蛋白发生泛素化, 对那些非可药性靶标以及蛋白-蛋白相互作用也可因之而降解。分子胶具有分子量更小,化学机构更简单,空间干扰少(relaxed steric interference)和成药性更好的特点。但毋庸置疑的是,分子胶无法像PROTAC那样通过对各组分的大规模筛选来实现,它的设计会比PROTAC难很多。确定分子胶化合物需要广泛的理性研究, 包括结构生物学、生物化学、生物物理学、谱学和基因变异组学等。
分子胶的发展历程
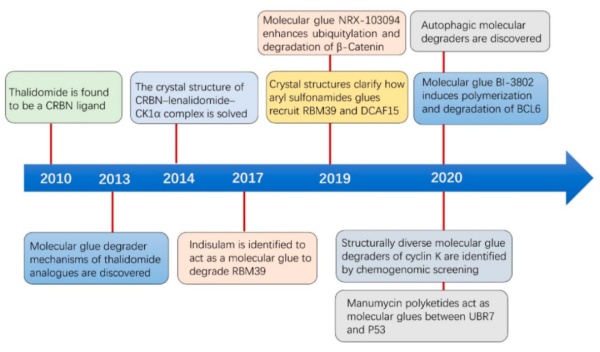
早在上个世纪70和80年代,科学家已经开始使用环孢菌素A(Cyclosporin A)和FK506用于防止器官移植排斥反应,在1991年才确认这两个分子是以分子胶的机制发挥作用;1996年,Deb Hung等人发现了天然产物圆皮海绵内酯(Discodermolide),它可以稳固α和β微管蛋白单体的结合;到2000年发现大环内酯WDB002,科学家开始拓展使用FKBP12作为分子胶合成途径,为简单合成化合物诱导天然蛋白的结合开辟了新的方向。
2014年,科学家在Nature杂志报道免疫调节药物沙利度胺(Thalidomide,1950s用于治疗妊娠恶心呕吐,1990s用于多发性骨髓瘤)通过分子胶机制发挥作用,研究发现这类药物通过靶向E3泛素连接酶CRBN,从而使转录因子IKZF1和IKZF3多聚泛素化,导致IKZF1和IKZF3被蛋白酶体降解。随着对分子胶作用机制的认识逐步加深,分子胶的发现也从偶然发现逐渐过渡到理性设计,同时伴随着更多的分子胶项目被逐渐报道。
分子胶的种类
1、天然药物的分子胶
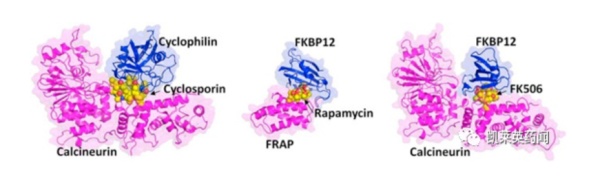
最早的药物发现源于哈佛大学S. Schreiber等人在1991年进行的结合两个蛋白引发生物效应的研究,环孢菌素A(cyclosporin A, CsA) 和他克莫司(tacrolimus, FK506)分别属于环肽和大环内酯的结构类型,结合的受体蛋白分别是亲环素(cyclophilin)和FK结合蛋白(FKBP),但发现后继的分子机制却是相同的,都结合钙调磷酸酶(calcineurin)形成三元复合物,钙调磷酸酶是依赖钙/钙调素的磷酸酶的催化亚基,选择性地水解蛋白中丝/苏氨酸上的磷酸基。环孢菌素A和他克莫司犹如分子胶分别将各自的靶标蛋白与钙调磷酸酶“粘黏”在一起,导致靶标的抑制,这是最早被称作分子胶的药物。
另一个具有免疫抑制作用的抗生素雷帕霉素(rapamycin)也结合于FKBP,用亲合色谱证明雷帕霉素-FKBP结合于哺乳动物雷帕霉素靶标蛋白(mTOR)。mTOR是细胞生长和增殖的重要因子,它的变异与肿瘤密切相关。由于雷帕霉素介导非可药性靶标mTOR生成FKBP-rapa-mTOR三元复合物,认为其扮演了分子胶的角色。上述天然药物介导两个蛋白的相互作用,形成的三元复合物阻断了靶蛋白的功能,所以它们被称之为分子胶。
2、度胺类的分子胶
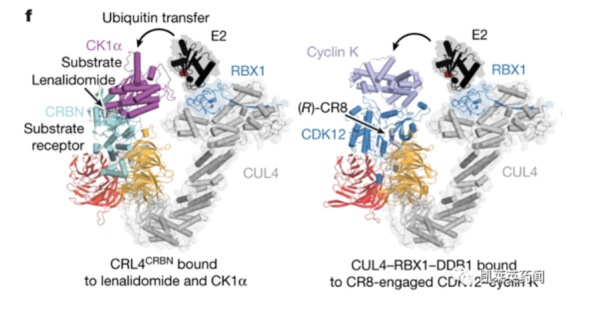
B. Ebert等在2014年报道了第一个发挥蛋白质降解作用的分子胶降解剂来那度胺(lenalidomide),研究发现来那度胺结合于泛素E3连接酶CUL4-CRBN蛋白上,呈现多效性反应,是由于靶蛋白的泛素化而引发的。作为E3连接酶的CUL4具有特异性,被CRBN的蛋白所调控。此外,来那度胺以及类似物沙利度胺(thalidomide)和泊马度胺(pomalidomide)等还可以同该连接酶的其他蛋白结合,例如介导对酪蛋白激酶1α(CK1α)的降解反应,揭示了来那度胺治疗与染色体5q缺失相关骨髓增生异常综合征的作用机制。
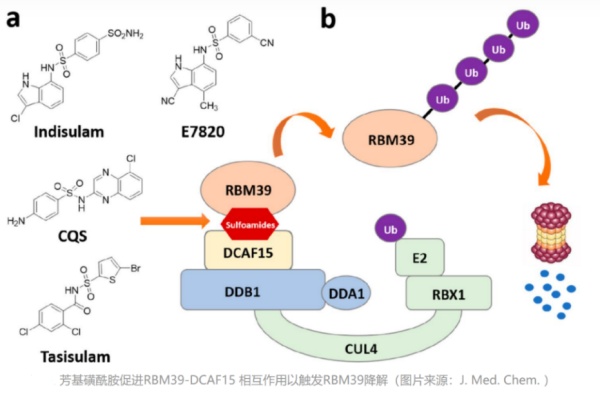
4、化合物CR8
前面的范例是在已知抗肿瘤活性的机制研究基础上揭示出的分子胶,可谓由偶然发现得来的,化合物CR8则是有目的筛选而发现的。Sabicki等将4518个药物或临床前小分子与578株肿瘤细胞温孵,测定了499株细胞中E3泛素连接酶的mRNA水平,发现由于CR8的作用,肿瘤细胞中DCAF15蛋白的表达水平降低,这与CUL4衔接蛋白DDB1的mRNA水平相关联。CR8作为分子胶,结合于CDK12-cyclin K,并与E3连接酶CUL4的衔接蛋白DDB1之间形成复合物,从而使cyclin K发生泛素化,继之将其降解而杀伤肿瘤。在此,CR8参与的蛋白-蛋白相互作用绕过了对底物受体的互补性要求。
03
行业竞争格局和研发现状
PROTAC方面
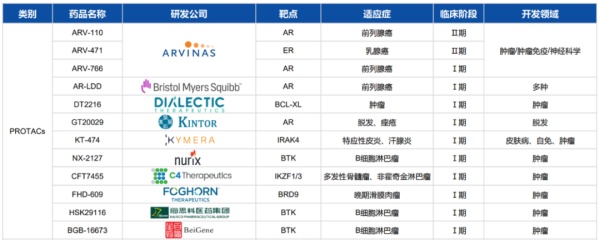
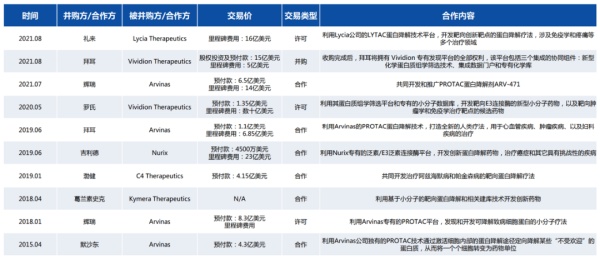
2018-2021年全球PROTAC融资额超过40亿美元,合作投入超过125亿美元。国外方面,Arvinas自2015年起获得大型药企的多次重磅交易,涉及默沙东、辉瑞、拜尔等巨头,最新的合作是2021年7月,辉瑞超20亿美元引进Arvinas的ARV-471全球权益。Nurix 2019年6月与吉利德达成了23.45亿美元的全球战略合作,2020年1月与赛诺菲达成了25亿美元的战略合作;Kymera 2020年7月与赛诺菲达成了总金额超20亿美元的多项目战略合作等。此外,以上公司均以临床前阶段的PROTAC产品管线就成功上市,也充分显示了资本界对这一革命性创新技术的认可和期待。
国内方面,2021年国内有超13家PROTAC相关企业完成了数千万至亿元融资。比如,凌科药业2021年8月完成5000万美元B轮融资(礼来亚洲领投);珃诺生物2021年8月完成逾4000万美元B轮融资(龙磐投资和上海生物医药基金共同领投);标新生物2021年11月完成了过亿元人民币Pre-A轮融资(沂景资本领投)等。
分子胶方面
分子胶方面,沙利度胺及其衍生物(来那度胺和泊马度胺)具有免疫调节、抗炎和抗肿瘤作用而被美国FDA批准上市,用于治疗多发性骨髓瘤等疾病。而在后续的机制研究偶然发现沙利度胺及其衍生物也作为分子胶降解剂,通过诱导CRBN与底物蛋白(IKZF1/3等)的PPI,促进底物蛋白的泛素化和降解。
那度胺(Lenalidomide)作为沙利度胺的第二代改良衍生物,近年来一直排名小分子药物的销售额前三名,2020年销售额更是达到121亿美元,作为沙利度胺的第三代改良衍生物的泊马度胺(Pomalidomide)2020年销售额也达到了31亿美元,度胺类分子胶取得的巨大成功也鼓舞了更多企业投入到分子胶开发中,但目前进入临床阶段最多的管线还是来自于新基和BMS。
不完全统计,目前国内布局分子胶管线的企业有正大天晴、Seed Therapeutics(万春医药子公司)、睿跃生物、分迪药业、康朴生物、标新药业、美志医药、达歌生物等,其中康朴生物的进展最快,已进入美国临床Ⅱ期。
04
PROTAC技术未来发展方向
确定更适用蛋白降解技术的靶点
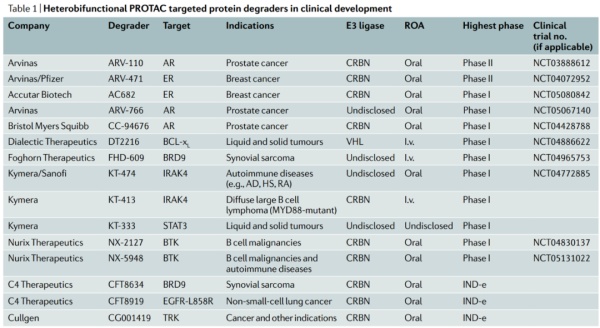
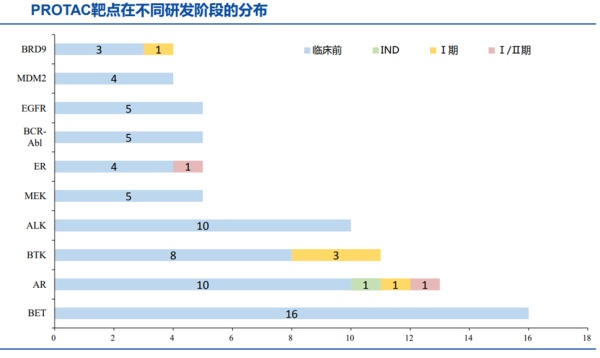
目前进入临床的PROTAC主要是靶向于已经验证过的成熟靶点,如下图所示:进入临床的PROTAC管线中,靶点集中在AR、ER、BTK这些成熟靶点上,国内进度靠前的几家都是做的BTK,靶点非常集中。
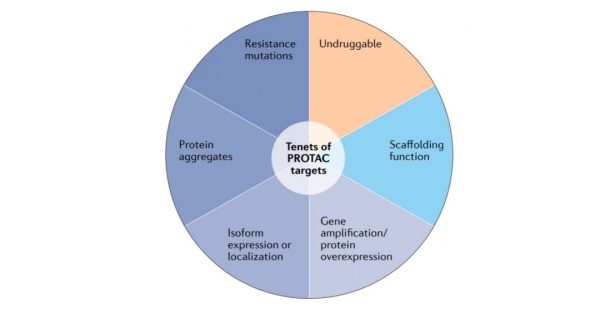
但PROTAC更大的价值在于靶向难成药靶点或尚未触及的新靶点,因此,未来需要去拓展其他靶点范围。目前研究报道的,适用于PROTAC技术的靶点包括:偏离正常状态的蛋白,如过表达、基因突变、聚集,异构体表达或定位产生获得性功能的致病蛋白,对常规靶向疗法产生耐药性的蛋白,具有骨架功能的蛋白和用其它治疗模式“不可成药”的蛋白等。
拓展E3连接酶范围
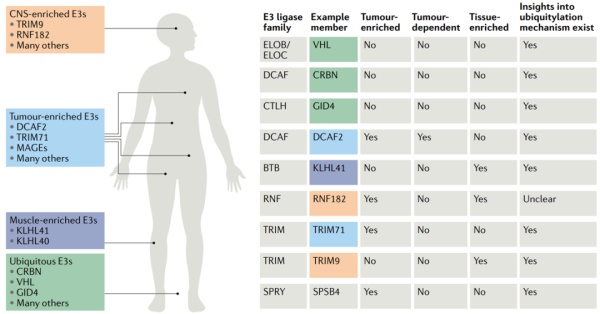
人体有近600种E3连接酶可供探索,但目前进入临床的PROTAC化合物只利用了CRBN和VHL两种E3连接酶。尽管现有的CRBN和VHL E3连接酶已经成功地被应用于靶向蛋白降解技术,开发新的E3连接酶还是很有必要。尤其是在肿瘤领域,肿瘤突变可能会产生针对这两种E3连接酶的耐药性。如下图所示,除了CRBN和VHL,其他几种E3连接酶如DCAF2、RNF182等,也逐步开始得到研究。
拓展肿瘤之外的临床治疗的疾病领域
虽然目前临床阶段的PROTAC都集中于肿瘤领域,但靶向蛋白降解的治疗领域正在超越肿瘤领域,比如:
炎症,免疫和免疫肿瘤:Nurix的BTK降解剂(NX-5948)和Kymera的IRAK4降解剂(KT-474),可以治疗免疫炎症疾病,如类风湿关节炎。
神经学和神经退行性病变:一些神经退行性疾病涉及某些蛋白的积累而产生的毒性,如Tau,huntingtin (mHTT)突变体,TAR RNA结合蛋白 (TARDBP) 等。
抗病毒领域:抗病毒PROTAC的可行性最早是在降解丙肝病毒(HCV)的NS3/4A蛋白中得到证实。目前针对新冠病毒的PROTAC正在紧密研究中,比如Nurix有三款靶向新冠的降解剂正在研究中。
拓展另类的PROTAC或蛋白降解模式
由靶向泛素蛋白-蛋白酶体的PROTAC衍生出了靶向自噬体的AUTAC,自噬体牵引的ATTAC,靶向溶酶体的LYTAC等多种新的蛋白降解模式,这些也是未来需要关注的新方向,但目前均起步较早,比如自噬降解方面,还面临着基础机理尚未阐明等问题。
来源:匡瑶 高特佳投资


{replyUser1} 回复 {replyUser2}:{content}