治疗时机是否需要前移?阴茎癌的免疫疗法管线汇总
阴茎癌是一种罕见疾病,人乳头状瘤病毒(HPV)感染是发生阴茎癌的主要风险因素,2019年发表的一项荟萃分析结果显示,50.8%的阴茎癌患者HPV阳性;其他风险因素包括未行包皮环切术、包茎、吸烟等。
单独手术可有效治疗局部疾病,但对于腹股沟或盆腔淋巴结受累较多的患者通常无法治愈。美国国家综合癌症网络(NCCN)和欧洲泌尿科协会(EAU)指南,通常建议淋巴结阳性患者接受新辅助化疗(NAC),然后进行淋巴结清扫。
阴茎癌中的肿瘤免疫微环境
鉴于阴茎癌的罕见性,这种疾病的分子病因尚不十分清楚——尤其是对于HPV阴性的阴茎癌。目前已发现阴茎癌中常见的基因改变(如NOTCH1、CDK2NA和PI3KCA)、TP53突变和HPV阳性状态的频繁相互排他性以及PSCC中可能导致肿瘤发生和疾病进展的分子通路改变(如DNA损伤反应和mTOR通路)。
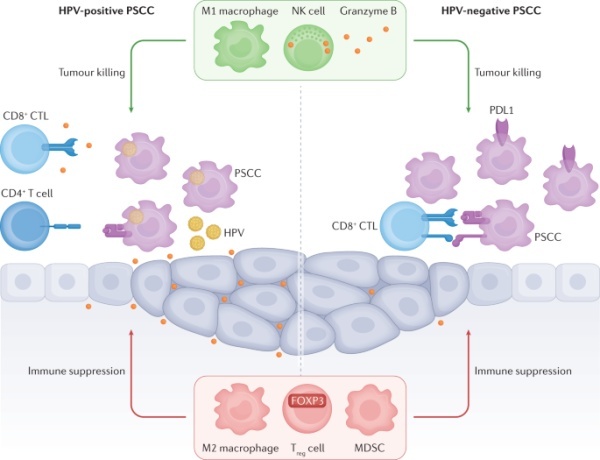
图1:阴茎癌的免疫景观
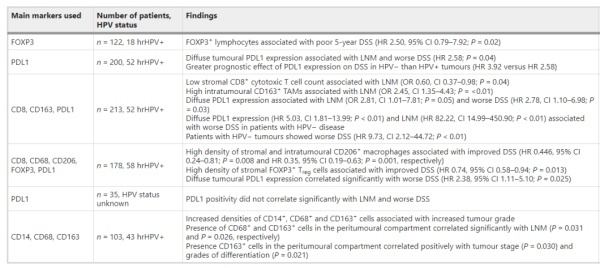
尽管目前ICB在阴茎癌中的应用有限,但已经进行了几项研究来表征PDL1在该疾病中的表达。在一项研究中,69.2%的LNM患者在原发肿瘤中显示PDL1阳性,而另一项研究的结果显示,在分析的40%原发肿瘤样本中显示PDL1阳性。
阴茎癌的免疫疗法
基于免疫的治疗很少作为阴茎癌管理的标准治疗。基于目前对阴茎癌TIME的理解,阴茎癌基于免疫的治疗存在未满足的需求。
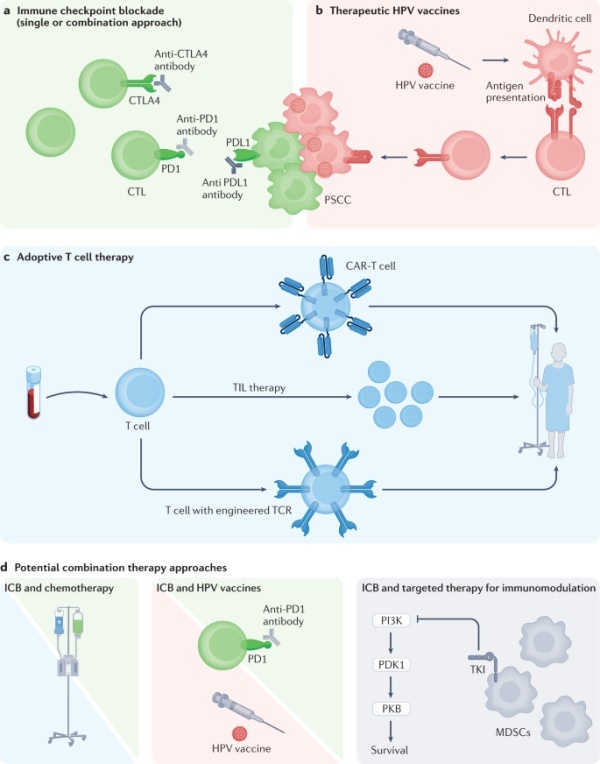
图2:阴茎癌的潜在免疫疗法
与复发性和转移性阴茎癌相关的结局不佳;因此,病程早期积极治疗对于尽可能减少复发机会和改善生存结局至关重要。目前NCCN和EAU指南推荐NAC用于局部晚期疾病,但仅约一半有资格接受化疗的患者从中获益。
总体而言,与化疗相比,使用ICB产生的不良反应更少;因此,ICB可能是阴茎癌患者的首选方式,这些患者发生化疗相关毒性反应的风险可能增加,管理潜在不良反应的能力有限。
HPV感染导致发生阴茎癌的风险增加,在一些高危型HPV阳性组织学亚型中,通过E6和E7癌蛋白的活性导致癌变。由于在整个肿瘤生命周期和病程中持续存在的HPV病毒活性,刺激免疫系统并增强CD8 + 细胞毒性T细胞对HPV阳性肿瘤应答的治疗性HPV疫苗已成为HPV相关恶性肿瘤的一种新的实验性治疗方法。
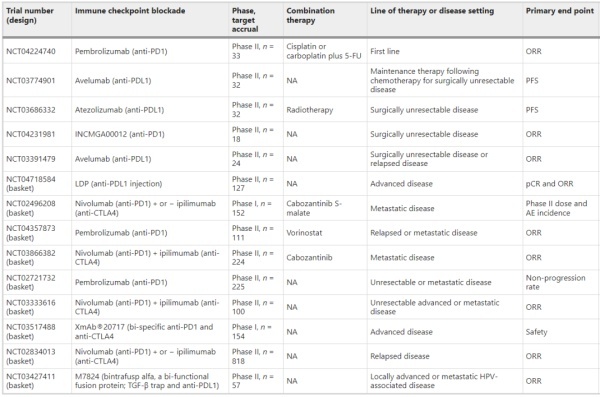
表3正在进行的研究治疗性HPV疫苗和其他HPV靶向治疗阴茎癌的临床试验
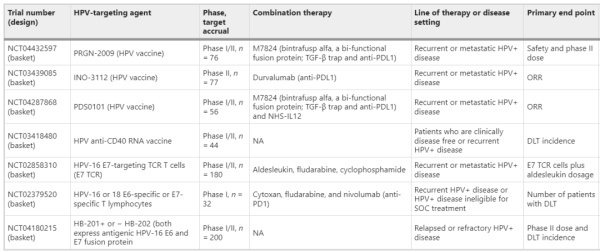
总体而言,HPV导向的疫苗提供了一个机会,通过单独或与其他基于免疫的治疗(如ICB)联合引起强烈的抗肿瘤免疫应答,特异性靶向HPV阳性阴茎癌肿瘤,并在TIME内对抗免疫抑制因素。
基于免疫的治疗在改善阴茎癌患者的结局方面具有巨大的潜力,但阴茎癌的免疫景观尚未得到充分表征,限制了我们准确评估该疾病最佳基于免疫的治疗的能力。由此可见,今后的工作应利用基因组学、蛋白质组学、代谢组学和单细胞技术等高通量技术,在高分辨率和本病的不同阶段进一步定义阴茎癌的免疫景观。
目前,有证据显示免疫标记物如PDL1在HPV阳性和HPV阴性癌症中的预后价值,表明常规的基于免疫的治疗如ICB可能对阴茎癌有效,特别是在围手术期和高危局部疾病的早期治疗。然而,目前正在进行的大多数涉及ICB的临床试验集中于复发、转移和/或治疗难治性疾病。因此,必须努力探索在病程早期使用ICB的潜在益处。
来源: 张虎 生物制药小编


{replyUser1} 回复 {replyUser2}:{content}