T细胞研究核心要点及最新热门靶点
T细胞是获得性免疫的重要组成部分,起源于骨髓中的淋巴样祖细胞,在胸腺中分化、发育、成熟,通过淋巴液和血液循环进入机体免疫器官之中发挥细胞免疫及免疫调节功能。T细胞是机体获得性免疫中发挥功能最为重要的一类淋巴细胞。根据其表面标志物和功能特征,T细胞可以分化为不同的亚群(如图1所示)。
根据T细胞分化阶段分类
(1)初始T细胞(Naive T-Cell):是指未经抗原刺激,还未分化成熟的T细胞。
(2)效应T细胞(Effector T-Cell):是指经过抗原刺激,增殖分化,成熟可以执行效应功能的T细胞。具有细胞因子释放,细胞杀伤等功能。
(3)记忆T细胞(Memory T-Cell):是指一些经过抗原刺激,增殖分化形成的能够长期存活,可以介导再次免疫的细胞。
根据T细胞功能分类
(1)辅助性T细胞(T helper cells, Th)为CD4+ T细胞,包括Th0,Th1, Th2, Th9, Th17, Th22, Tfh等。其中未激活的初始CD4+ T细胞为Th0,在各种抗原和细胞因子的刺激与调控下,分化成不同类型的Th。
(2)细胞毒性T细胞(Cytotoxic T cell)为CD8+T细胞,被激活后可以释放细胞因子,穿孔素,颗粒酶用于杀伤病毒感染的细胞或者肿瘤细胞。
(3)调节性T细胞(Regulatory T cell,Treg)为体内维持免疫平衡的一类T细胞,既有CD4+T调节性T细胞,又有CD8+T细胞,这类T细胞通常与自身免疫疾病及肿瘤进展相关。
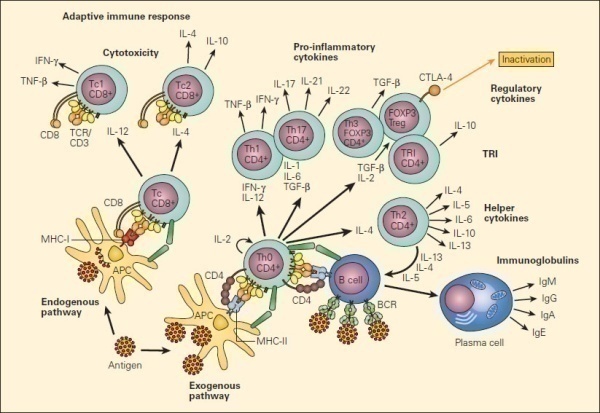
图1.T细胞分化及类型
2
TCR与CD3分子形成TCR-CD3复合物,TCR负责识别抗原肽,CD3负责将TCR接到的细胞外刺激信号传导到胞内,经过胞内信号传导将细胞外刺激信号转化为细胞功能活化信号。如图2所示,研究表明Naïve细胞激活需要两个不同的细胞外信号的共同刺激:第一个信号来自于抗原,由APC表面的MHC-抗原肽复合物与TCR(包括CD4和CD8)的相互作用形成复合物,由CD3传入细胞内,该信号保证了免疫应答的特异性。第二信号为共刺激分子的结合,其提供方式为APC表面的共刺激分子与T细胞表面相应配体的相互作用和结合,该信号确保免疫应答在需要的条件下才能发生。目前研究最为清楚的共刺激分子包括APC表面的CD80,CD86,T细胞表面的CD28,T细胞表面的CD28向胞内传递活化信号,包括促进IL-2产生和初始T细胞分化成为效应T细胞和记忆性T细胞。其他第二信号分子配体对包括ICAM-1/LFA-1、LFA-3/CD2、B7-H2/ICOS、CD40/CD40L等。
当T细胞只有第一信号,缺乏第二信号时,T细胞处于无应答状态,必须在第一信号和第二信号同时存在时,T细胞才发生活化。第二信号确保在正确的时间与部位启动T细胞应答。T细胞的活化信号触发了某些T细胞膜蛋白和细胞因子的基因转录与蛋白质表达,这一结果引发了活化后细胞的分裂和分化,T细胞增值与活化并行。专职APC经MHCⅡ途径提呈外源性抗原刺激初始CD4+T细胞活化,分化成为辅助T细胞。APC经MHCⅠ类途径提呈内源性抗原刺激CD8+T细胞活化、分化成为细胞毒性T细胞。活化的T细胞具有分泌细胞因子与杀伤细胞的功能。
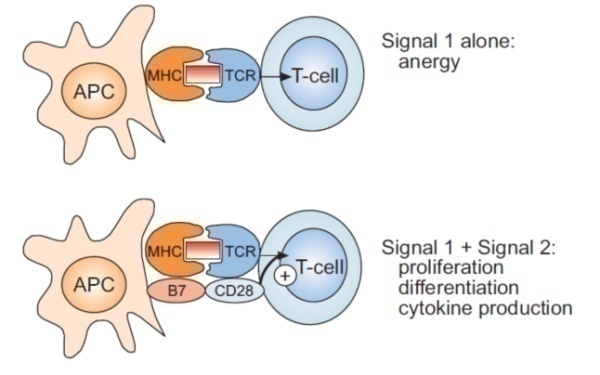
图2.T细胞激活的两个信号
T细胞体外激活与扩增
如图3所示,体外T细胞的刺激便于T细胞的激活与扩增,为T细胞功能研究以及T细胞治疗提供了便利,丝裂原分子和抗体是常用的体外刺激分子。常用的丝裂原分子主要作用于TCR,CD2,CD3,CD28和CD45等分子。单克隆抗体以其特异性可以特异性结合TCR-CD3复合物绕过TCR-MHC抗原肽复合物经典通路提供T细胞激活的第一信号,但是扩增还需要依赖共刺激信号,通常由CD28分子提供【4】。游离的抗体可以结合在T细胞表面,但是无法让受体产生足够的交联成簇,也就无法有效的激活T细胞。因此借助辅助细胞,或者将抗体包被使用,更为简洁方便的是将CD3和CD28抗体偶联磁珠,该类产品是将CD3和CD28抗体偶联在直径约为4.5μm左右的磁珠上,使用是将细胞与磁珠按比例混合后混匀后培养,刺激结束用磁力架吸附轻松移除磁珠,终止刺激。运用4.5μm抗体偶联磁珠大小与细胞大小完美匹配、模拟APC高效激活扩增T细胞。
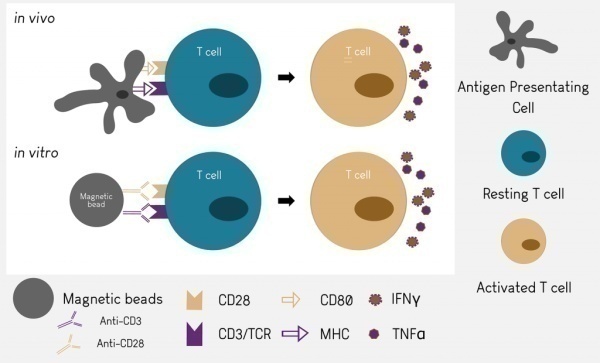
图3.T细胞体内外激活途径
3
T细胞免疫疗法是一种利用自身免疫细胞更好杀伤肿瘤细胞的治疗方法。目前有三种重要的T细胞免疫疗法(图4),即TIL疗法,TCR-T细胞以及CAR-T疗法。三类T细胞疗法都是收集分离自身免疫细胞,在体外进行大量扩增或者基因工程化改造并扩增后回输给病人,该疗法称为细胞免疫疗法。
采集的病人T细胞,一般需要2-8周左右的增殖时间。在此期间,病人可以采用化疗,放疗来清除一些其它免疫细胞,减少一些自身免疫细胞有助于提升过继T的效应功能。通过这些处理之后,体外培养、改造、扩增的T细胞回输病人获得治疗。
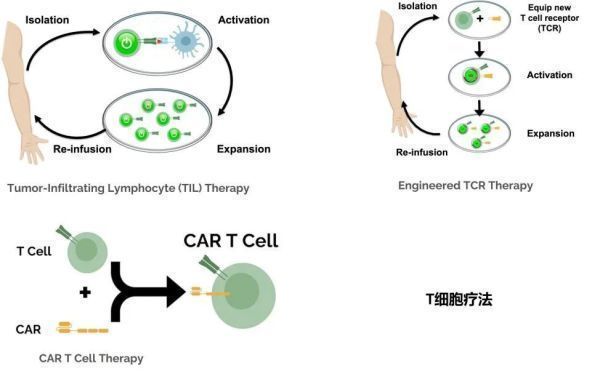
图4.T细胞疗法
TIL疗法
即肿瘤浸润T淋巴细胞,最早发现于肿瘤组织,医生发现有一群淋巴细胞可以更好地识别肿瘤细胞,但是在数量上还不足或者因为肿瘤微环境的抑制信号使得它们无法完全杀伤肿瘤细胞,随后他们分离了这群淋巴细胞,并实现了体外快速扩增与激活,最后将这群细胞回输给患者,大量激活的TIL细胞在患者体内精确定位寻找并杀伤肿瘤细胞。
工程化TCR疗法
并不是所有患者都有那样幸运可以识别肿瘤细胞的T细胞,一些患者由于种种原因,无法分离得到大量扩增激活的T细胞,对于这些患者,医生一般采用工程化TCR-T细胞疗法,该方法也需要分离病人的T细胞,取代体外扩增激活的办法是采用基因工程化对T细胞进行编辑,给T细胞装载一个能特异性识别肿瘤抗原的TCR,这一策略允许医生根据病人肿瘤的具体情况设计不同的TCR,更加个性化。最后将工程化T细胞激活,扩增回输给患者。
CAR-T疗法
无论是TIL还是TCR-T细胞疗法,识别肿瘤抗原都必须依赖于形成TCR-MHC抗原肽复合物,为了克服这一局限性,CAR-T应用而生。科学家给T细胞装载上可以特异性识别肿瘤细胞表面抗原的一段序列即嵌合抗原受体(CAR),通常CAR是一段抗体序列,通过对CAR的精心设计,使得T细胞可以特异性识别肿瘤表面抗原,从而绕过了T细胞通过形成TCR-MHC抗原肽复合物被激活的通路,CAR与肿瘤细胞表面抗原的结合就可以激活T细胞,拓宽了T细胞治疗的应用场景。
抗原结构域
一般为与肿瘤细胞表面抗原结合的特异性抗体形式,有抗体的单链可变区片段scFV,有纳米抗体VHH,目前还有结合双抗原表位的scFV串联形式,两个VHH的串联形式等,主要负责特异性识别肿瘤表面抗原。
间隔结构域
从功能上讲,间隔结构域主要起到联系抗原识别结构域与跨膜结构域的作用,通常选用CD8α或者CD28的胞外区部分,间隔结构域的长短取决于抗原识别结构域所识别的抗原表位,及抗原表位的可及性。
跨膜结构域
跨膜结构域主要传导CAR识别抗原的信号到胞内结构域以及T细胞的其他一些膜蛋白。通常跨膜结构域来自CD4, CD8α,CD28 和 CD3ζ,他们的选择最终极大地影响着CAR-T的作用效果。
胞内共刺激结构域
胞内共刺激结构域通常来自于CD28家族(CD28,ICOS)或者肿瘤坏死因子受体家族(4-1BB, OX40, CD27). (4-1BB, OX40, CD27)。共刺激结构域可实现协同刺激分子和细胞内信号的双重活化,使T细胞持续增殖并释放细胞因子,提高CAR-T的抗肿瘤能力。
CAR-T疗法
CAR-T疗法至今经历了五代(图5):第一代CAR-T仅依赖于CD3ζ介导T细胞激活,由于胞内缺乏共刺激结构域,自然缺少共刺激信号,因此T细胞激活有限,而且无法长时间扩增,临床疗效有限;第二代CAR-T在胞内信号转导区增加一个共刺激分子(CD28、4-1BB、ICOS 或 OX40等)延长了T细胞的增殖时间,提高了CAR-T活性。第三代 CAR-T在二代基础上增加了一个共刺激结构域,在现有的共刺激结构域中,大量的CAR-T采用了CD28和4-1BB作为共刺激分子,研究表明4-1BB作为共刺激信号的CAR-T细胞在体内扩增更温和持久,发生细胞因子风暴风险较低,杀伤肿瘤效果更好,复发风险低;第四代CAR-T引入了组成型或者诱导表达的促炎症细胞因子(IL-12、IL-15、IL-18 等)和共刺激配体,可以有效解除肿瘤免疫微环境的抑制,例如,当CAR-T细胞中过度表达的细胞因子是IL-12,可以增强T细胞分泌IFNγ、颗粒酶B和穿孔素的有效分子,从而招募NK细胞等免疫细胞杀伤CAR-T未能识别的肿瘤细胞,起到联系固有免疫与获得性免疫的桥梁作用;第五代CAR-T则是在第二代的基础上,添加了激活其它信号通路的共刺激结构域,比如IL2-2Rβ胞内结合STAT3/5 的结构域等。
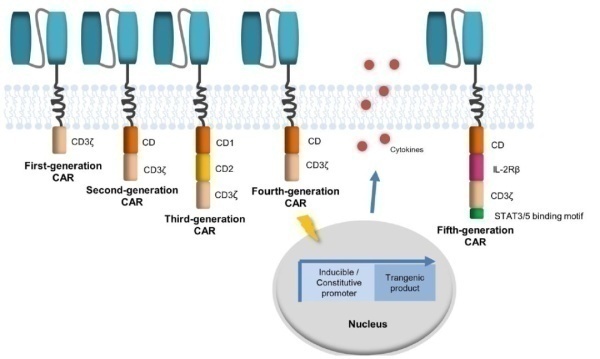
图5.CAR-T疗法发展历程
细胞免疫疗法研究现状
目前全球已有7款CAR-T疗法获批上市,分别是:
诺华 的 Kymriah (tisagenlecleucel);
Gilead/Kite 的 Yescarta (axicabtageneciloleucel);
吉利德 的 Tecartus (brexucabtageneautoleucel);
BMS 的 Breyanzi (lisocabtagene maraleucel);
BMS 和 蓝鸟生物 的 abecma (idecabtagenevicleucel);
复星凯特 的 阿基仑赛注射液;
药明巨诺 的 瑞基仑赛注射液。
细胞治疗趋势与热门治疗方式
如图6所示,截止到2022年4月15日,在全球肿瘤免疫细胞治疗管线中有2756种处于活跃开发状态的细胞疗法,而2021年的活跃状态有2031种,同比增长36%,这意味着肿瘤细胞治疗的研发增长了36%。相较2020年至2021年与2019年至2020年的增幅43%和61%略有放缓,其中NK细胞疗法放缓了增速(去年同比增长55%,前年增长65%);CAR-T细胞疗法去年同比增长24%,低于2020-2021年38%的增长,尽管如此,CAR-T细胞疗法依然继续引领着细胞治疗管道。除了具体的细胞疗法,异体细胞疗法相比自体细胞疗法也有增长,去年异体细胞疗法增速为33%,自体细胞疗法增速为23%。
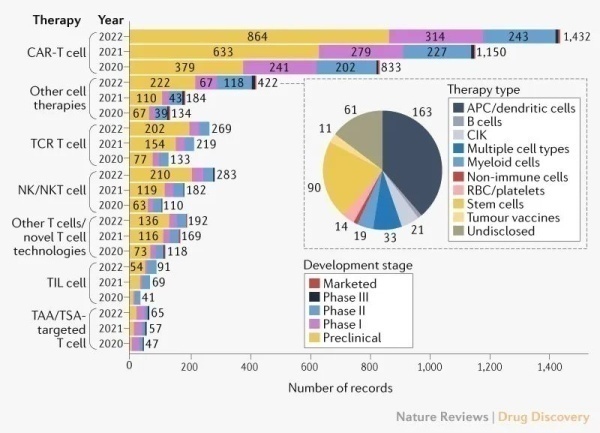
图6.全球免疫肿瘤学管线概况
细胞治疗热门靶点
2021年,血液肿瘤治疗领域,TOP5热门的靶点仍然是CD19,BCMA,CD22,CD20,CD123。尽管一些靶点还不在TOP5,但这些新靶点增长趋势迅猛,比如GPRC5D增长200%,CLEC12A增长114%,CD7增长78%。实体瘤治疗领域热门靶点,肿瘤相关表面抗原TAA,HER2,MSLN,GPC2/3,EGFR占据TOP5,尽管也有一些靶点还不在热门靶点榜单,但是发展势头超乎寻常,CLDN18增长400%,CD276增长160%,就连带着不可成药魔咒标签的Kras也增长125%(图7)。
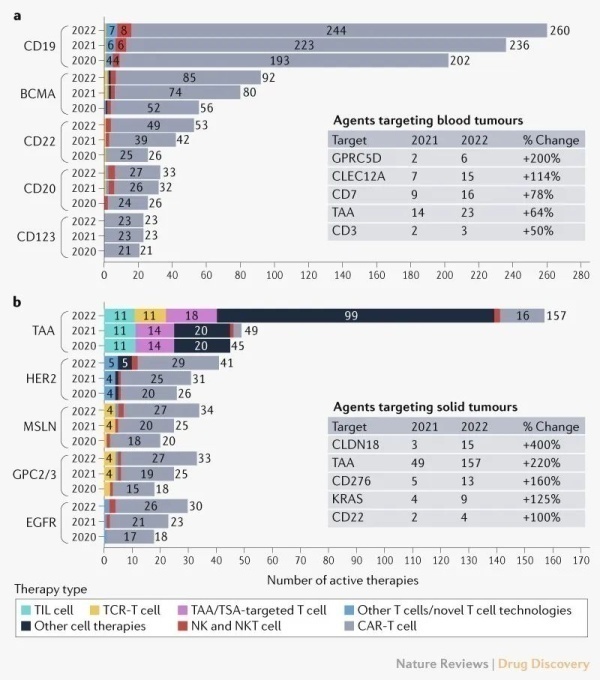
图7.血液肿瘤和实体瘤细胞疗法的主要靶点
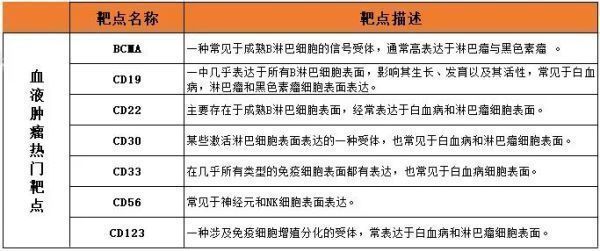
细胞治疗领域热门靶点如下:
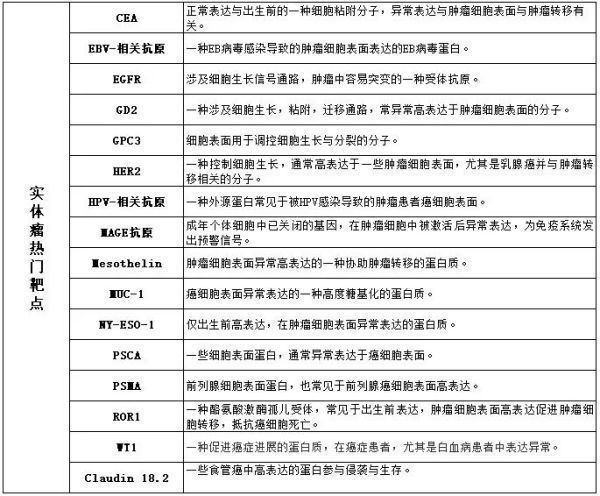
根据ClinicalTrials.gov数据显示,截止2022年4月,有近1800项细胞治疗临床试验处于活跃状态(图8)。与去年相比,同比增长33%,2020-2021年的增速为43%,2019-2020年的增速为24%。这种缓慢现象在包括NK/NKT细胞治疗的所有细胞治疗中。尽管2020下半年这种缓慢增速略有恢复。其它细胞疗法持续增速,与前些年一致,细胞治疗依然集中在血液肿瘤治疗领域。但是评估实体瘤细胞治疗疗效的试验有了显著增速,2021-2022增速为43%。
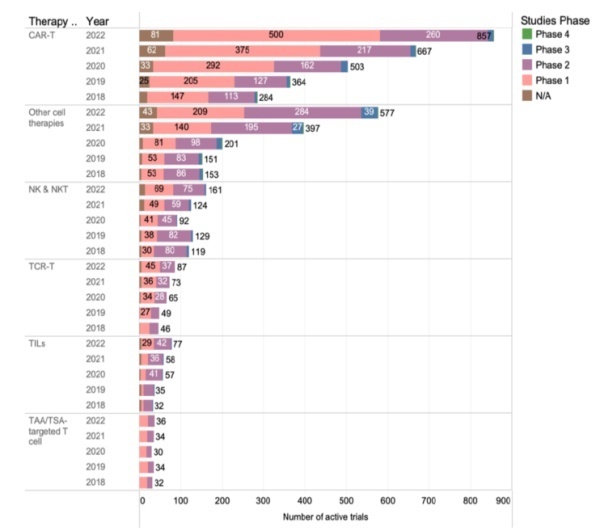
图8.全球细胞治疗临床试验增速概况
讨论:细胞疗法尽管增速与前些年相比有所放缓,但是T细胞疗法仍然遥遥领先。细胞治疗临床研发管线仍然处于增长状态。这种增速放缓的主要原因是不依赖于T细胞治疗的其他细胞疗法已经有所固化,限制了这些疗法的增长。可能的原因是独立的特定靶点,更好的安全性、与T细胞疗法互补的作用机制或它们“快速”生产的可行性等等。根据ClinicalTrials.gov数据显示,尽管实体瘤治疗领域有所增速,但是CAR-T疗法在实体瘤领域的应用仍然赶不上研发速度。一些关键的限制因素可能是对患者资格、治疗费用、旅行要求和相关患者的负担不完全了解。未来,学术界、政府和工业界必须继续合作,更加重视细胞疗法的培训、实施、报销和商业化战略。临床发展的限制因素应该和临床研究并行。这样我们可以在实现临床研发管线增速的同时,更好的将成果及时转化。
来源: seafrom 生物制品圈


{replyUser1} 回复 {replyUser2}:{content}