里程碑!NASH新药不到半年就能起效,医药产业怎么看?
“我们相信今日HARMONY试验的结果对Akero,乃至对整个非酒精性脂肪性肝炎(NASH)患者群体,都是一项重要的里程碑!”
——Akero总裁兼首席执行官Andrew Cheng博士
近日,业内传来一项重磅消息。在广受关注的NASH治疗领域,一家名为Akero Therapeutics的生物技术公司宣布其一款新药取得重要进展。在短短24周的试验当中,这款新药显著改善了NASH患者的肝纤维化情形,幅度为对照组的2倍!若此结果在未来进一步获得证实,将有望为全球NASH患者带来历史性的改变!
NASH是一种影响广泛的疾病,患者由于肝脏脂肪累积过多,会出现慢性炎症,进而造成肝细胞的破坏与肝脏纤维化,严重时会导致肝硬化、肝衰竭、肝癌与死亡。据统计,在大中华地区,每100人中就有2.4-6.1人会罹患NASH。然而尽管NASH具有重大的未竟医疗需求,也一直是生物医药产业专注研发的方向,但大量治疗NASH的临床试验依旧以失败告终,迄今也仍没有治疗NASH的药物获批。这也解释了为何Akero今日的新闻甫一出炉,就得到了众多产业媒体的瞩目。
Akero带来的这款创新疗法名为efruxifermin(曾用名AKR-001),是成纤维细胞生长因子21(FGF21)的类似物。通过作用于不同成纤维细胞生长因子受体(FGFR),efruxifermin可以减少脂肪组织的水解,抑制肝脏内脂肪的生成,进而减缓肝脏内脂肪的累积,达到治疗NASH的效果。
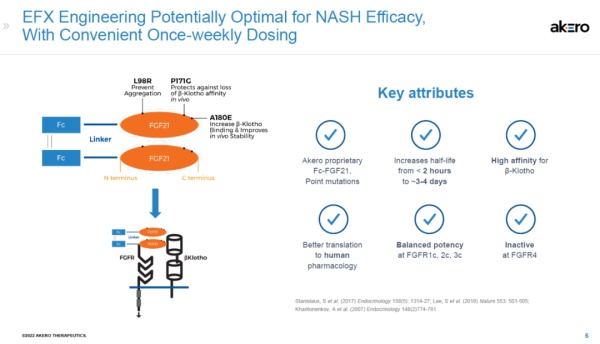
▲Efruxifermin简介(图片来源:Akero公司官网)
这款药物的潜力在一项名为HARMONY的临床2b试验中得到了验证。该试验共包含128位中重度NASH患者,且都具有疾病进展的高风险。这些患者被随机分配到三组,分别接受每周28 mg药物、50 mg药物或安慰剂的皮下注射。通过肝脏活检,研究人员们发现在高剂量组中,有41%的受试者其肝脏纤维化程度有显著改善,低剂量组中的比例也有39%。相比之下,对照组的数据只有20%。
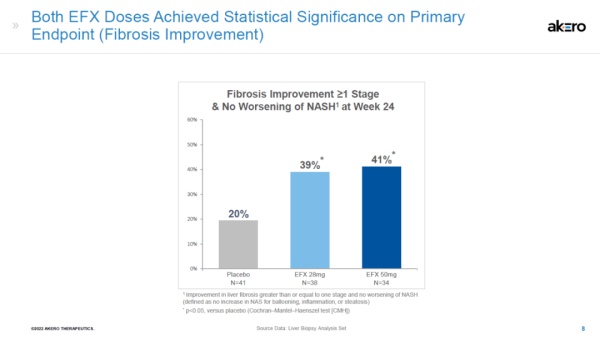
▲两种剂量的efruxifermin均达到试验主要终点(图片来源:Akero公司官网)
此外,高剂量组中有高达76%(p<0.001)的患者在肝纤维化没有恶化的情况下,NASH症状获得缓解,低剂量组中的数据也有47%(p<0.01)。相比之下,只有15%的安慰剂组患者达到同样的临床标准。此药物也展现良好的耐受性,最常见的不良反应为1、2级的腹泻、恶心与食欲增加。在试验中有5位患者因副作用而必须停止治疗,有1位出现药物相关严重不良反应。
值得一提的是,美国FDA先前公布的NASH药物临床3期试验注册的指南草案中,指出这两种肝脏组织学评估可以作为临床终点。Akero这次所公布的数据满足FDA对NASH药物开发的临床要求,释放出积极的信号。
Akero的试验结果公布后,迎来了许多媒体的报道与讨论,而大多数对此数据表示乐观,例如行业媒体Fierce Biotech与STAT皆认为efruxifermin具有治疗肝纤维化,并最终成为NASH新药的潜力。而行业媒体BioSpace更是称efruxifermin为“充满潜力的奠基性药品!”杰富瑞(Jefferies)投资公司的董事总经理Michael Yee先生亦认为所公布的数据足以支撑此药物朝更大型的临床3期试验迈进。
行业媒体Endpoints News在乐观之余,则提醒产业关注药物的安全性——虽共有128位患者入组,但最终完成两次肝脏活检,进行疗效分析的患者只有113位。有5位患者因不良反应而停止治疗,另有4位患者出现严重不良反应。虽然出现严重不良反应的病患中只有1位被认为是与药物治疗相关,但药物的长期安全性数据无疑将会是这款新药获批的关键之一。
图片来源:123RF
Akero另外还有一项efruxifermin的临床2b期试验进行中。这项被称之为SYMMETRY的试验主要招募具肝硬化(晚期肝纤维化)的NASH患者入组,试验结果预计在2023年下半年公布。Akero打算在完成此项试验后,再与各监管单位进行更进一步的讨论。然而由于此药物已经获得欧洲药品管理局(EMA)的优先药品资格(PRIME),Akero可根据今日所公布的试验数据立即与EMA讨论。另一方面,公司的共同创始人兼首席科学官Tim Rolph博士亦表示将向美国FDA申请此药物治疗NASH的突破性疗法认定。
随着世界肥胖人口的增加,NASH患者的比率也逐渐提升,然而这项潜在致命的严重疾病直至目前仍是无药可医,期望以此次的临床试验结果为契机,未来我们能早日见证首款突破性的NASH治疗药物,造福世界各地更多的患者。
来源:药明康德
版权及免责声明:本网站所有文章除标明原创外,均来自网络。登载本文的目的为传播行业信息,内容仅供参考,如有侵权请联系答魔删除。文章版权归原作者及原出处所有。本网拥有对此声明的最终解释权。


{replyUser1} 回复 {replyUser2}:{content}