这个基因在超过50%癌症中发生突变!一文看懂攻克它的不同策略
TP53是人类癌症中最常见的突变基因之一,据估计,超过50%的癌症都携带TP53基因突变。自TP53在1979年被首次报道以来,科学家们已经对TP53编码的p53蛋白进行了深入的研究,然而p53也是肿瘤学研究中最难开发的靶点之一,目前尚未有靶向p53的有效手段获得FDA的批准。
随着对p53研究的进一步深入,科学家们正在利用不同手段靶向这一靶点,包括从传统的小分子药物,到双特异性抗体、蛋白降解疗法、基因疗法和RNA疗法等创新治疗模式。近日,Nature Reviews Drug Discovery上的一篇综述对靶向p53的不同手段进行了盘点。

p53在抑制癌症发生和发展中的作用
野生型p53的主要作用是作为转录因子,通过激活一系列基因的表达来限制肿瘤细胞的增殖和存活。此外,p53还具有转录因子以外的功能,它与BCL-2家族蛋白的相互作用可以促进线粒体激发的细胞凋亡。p53同时还是自噬作用的重要调节因子,并且能够影响肿瘤微环境,让其不利于肿瘤生长。
由于p53在抑制肿瘤生长方面的多重作用,TP53基因也是肿瘤中最常突变的的基因之一。大多数TP53基因突变为错义突变,导致p53蛋白不能正常行使抑制肿瘤生长的功能。不过也有些突变会让p53突变体产生促进肿瘤生长的功能,比如激活促进癌细胞生长的基因,降低内质网应激造成的细胞凋亡,改变肿瘤微环境等等。因此,p53是癌症治疗方面极具吸引力的重要靶点。
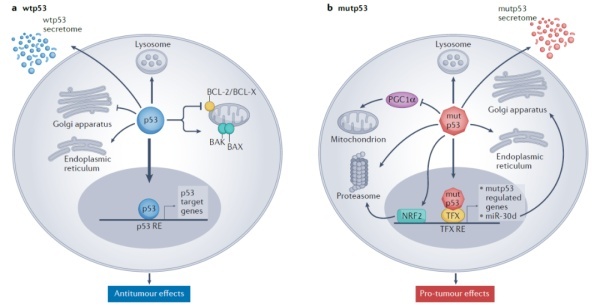
▲野生型p53和p53突变体的抑癌和促癌作用(图片来源:参考资料[1])
靶向p53的小分子药物
针对p53的小分子药物开发早在20多年前就开始了。由于大部分TP53基因突变导致p53结构的不稳定和功能丧失,靶向p53的小分子药物开发的主要目标是恢复p53的结构和表达水平,让p53能行使其正常的抑癌功能。目前正在开发的小分子药物可以分为三大类:第一类药物通过靶向p53表达的负调节因子(包括MDM2,MDM4和HPV E6),提高p53的表达水平;第二类药物通过靶向特定p53突变体,旨在恢复p53突变体的结构稳定性和功能;第三类药物针对由于TP53基因出现的无义突变而生成的截短p53蛋白。
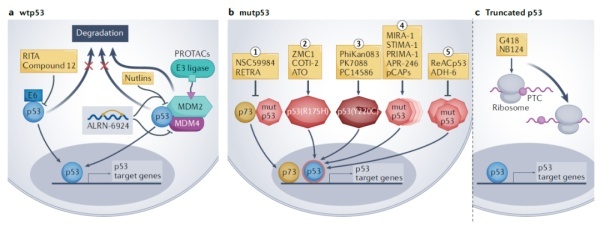
▲靶向p53的小分子药物开发策略(图片来源:参考资料[1])
靶向p53负调节因子的优势在于可以对野生型p53产生效果,并具有更为广谱的效力。比如,亚盛医药的MDM2抑制剂APG-115通过与MDM2结合,阻断MDM2和p53的相互作用,恢复p53的抑癌活性。它已经获得FDA的多项孤儿药资格,涉及适应症包括急性髓系白血病、软组织肉瘤(STS)、视网膜母细胞瘤(RB)、IIB-IV期黑色素瘤等。
此外,蛋白降解疗法也可以被用于降解抑制p53的调节因子,从而提高p53的水平。比如,Kymera Therapeutics公司靶向MDM2的蛋白降解药物KT-253已经在临床前实验中,表现出优于MDM2小分子抑制剂的活性。该公司预计在今年年底之前向FDA递交IND申请。
靶向p53突变体的小分子药物旨在通过与突变体结合,恢复p53的正常结构和功能。比如,近日在靶向KRAS方面做出突出贡献的Kevan M. Shokat教授实验室发表论文,描述了一款与p53 Y220C突变体结合的共价化合物,它可以将其热稳定性恢复到和野生型p53相当的程度。
这些靶向疗法由于针对特定TP53基因突变导致的突变体,因此对野生型p53的影响较小,毒性较低,不过TP53基因具有多种不同的基因突变,靶向特定p53突变体的策略不一定能够用于其它突变体。
针对由于无义突变产生的截短p53蛋白,目前的策略是使用促进核糖体通读(read through)的药物,或者抑制截短p53蛋白降解的药物来提高p53的水平。不过这些药物能否有效提高p53的水平仍然需要验证,并且它们的潜在毒性也是让人担忧的问题。
针对p53的免疫疗法
由于p53突变体大多在肿瘤细胞中高度表达,因此它们的多肽片段也更有可能被肿瘤细胞呈递到细胞表面,从而被人体的免疫系统识别。针对p53的免疫疗法增强人体免疫系统识别p53突变体的能力,并且激活针对p53突变体的免疫反应,从而消灭表达p53突变体的肿瘤细胞。
这一策略包括基于p53突变体的癌症疫苗,靶向p53突变体的单克隆抗体和双特异性抗体。比如,去年在《科学》杂志上发表的一项研究中,由约翰-霍普金斯大学(Johns Hopkins University)学者领衔的研究团队成功开发出靶向p53突变体的双特异性抗体疗法。它能以极高的特异性,识别突变p53多肽片段与人类白细胞抗原(HLA)蛋白构成复合体。同时,这一双特异性抗体的另一端可以与T细胞表面的CD3受体结合,激活T细胞杀伤表达p53突变体的肿瘤细胞。这一研究首次提供证据显示,靶向p53突变体的双特异性抗体,在细胞表面新抗原表达水平极低的情况下仍然能激活T细胞并消灭肿瘤细胞。
综述作者指出,这一策略的关键在于激发针对p53突变体的特异性免疫反应。正常细胞也表达p53,虽然大多数细胞p53水平很低,呈递在细胞表面的抗原更少,但是有些经常分裂的细胞(包括干细胞和祖细胞)的p53表达水平会升高,避免免疫系统攻击健康细胞是研究人员需要考虑的问题。
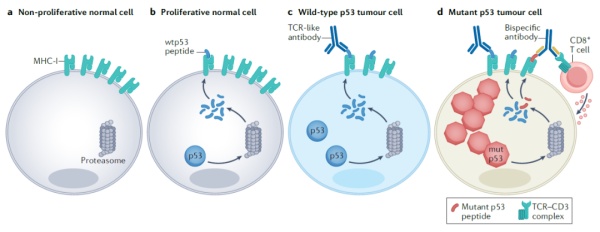
▲针对p53突变体的抗体疗法作用机制(图片来源:参考资料[1])
针对p53的基因疗法和RNA疗法
由于大部分TP53基因突变导致p53失活,因此使用基因疗法表达具有正常功能的p53也是恢复p53功能的一个重要研发方向。使用病毒载体或者脂质纳米颗粒,可以将编码野生型p53蛋白的转基因递送到肿瘤细胞中,恢复正常p53的表达,产生抑癌作用。
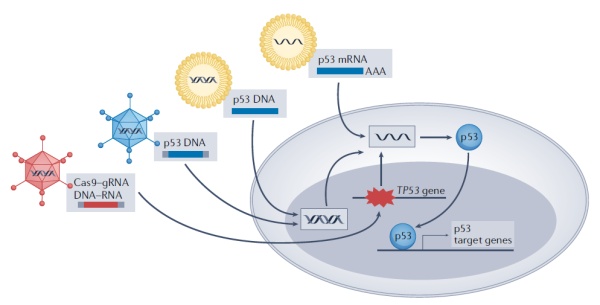
▲在基因和RNA层面针对p53的开发策略(图片来源:参考资料[1])
随着mRNA疫苗的成功,利用纳米颗粒递送编码p53的mRNA也成为药物开发的方向之一。今年2月,哈佛大学医学院和麻省总医院的研究团队在Nature Communications上发表论文,在肝细胞癌动物模型中,成功使用靶向CXCR4的纳米颗粒递送表达p53的mRNA。这一疗法与抗PD-1抗体联用,有效改变了肿瘤微环境的细胞和分子成分。
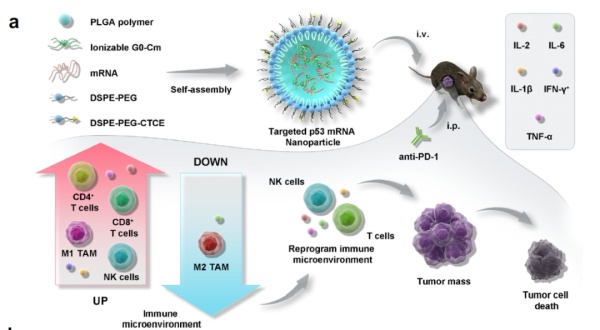
▲表达p53的mRNA与抗PD-1抗体联用,显著改变肿瘤微环境(图片来源:参考资料[2])
这一策略需要注意的一个问题是很多p53突变体不但自身功能缺失,而且由于表达水平升高,可能会起到阻断正常p53功能的作用。这种情况下,表达正常p53蛋白的效果可能并不显著。此外,有些p53突变体携带着促进癌症的功能获得性突变,表达正常p53蛋白并不能阻止这些突变体的致癌作用。
基因疗法和mRNA疗法之外,RNAi可以抑制突变TP53基因的表达,而CRISPR基因编辑系统具有修复TP53基因突变的潜力。
展望未来
综述作者指出,自2000年以来,多款靶向p53的疗法已经进入临床试验阶段,随着对p53突变体的进一步了解和筛选手段的进步,近10年来靶向p53的小分子药物在临床试验中的比例大幅度增加。
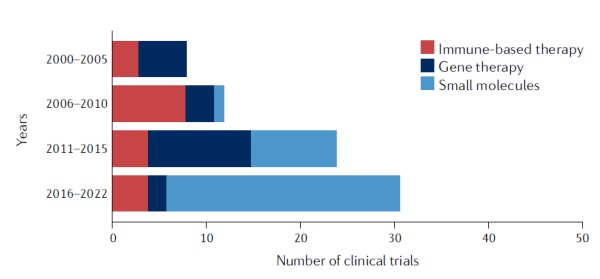
▲靶向p53的临床试验统计(图片来源:参考资料[1])
来源:药明康德
版权及免责声明:本网站所有文章除标明原创外,均来自网络。登载本文的目的为传播行业信息,内容仅供参考,如有侵权请联系答魔删除。文章版权归原作者及原出处所有。本网拥有对此声明的最终解释权。


{replyUser1} 回复 {replyUser2}:{content}