下个癌症疗法突破关键?一图看懂近期癌症临床转化潜力靶点
大多数癌症患者具有极大的未竟医疗需求,改善各类癌症的治疗也一直是生物产业研发的方向,而带来根本性改变的疗法常常源自于实验室的发现。药明康德内容团队为大家盘点近期在各顶尖科学期刊上所发表,具有潜力成为治疗癌症靶点的文章,以作为各界癌症疗法开发的参考!
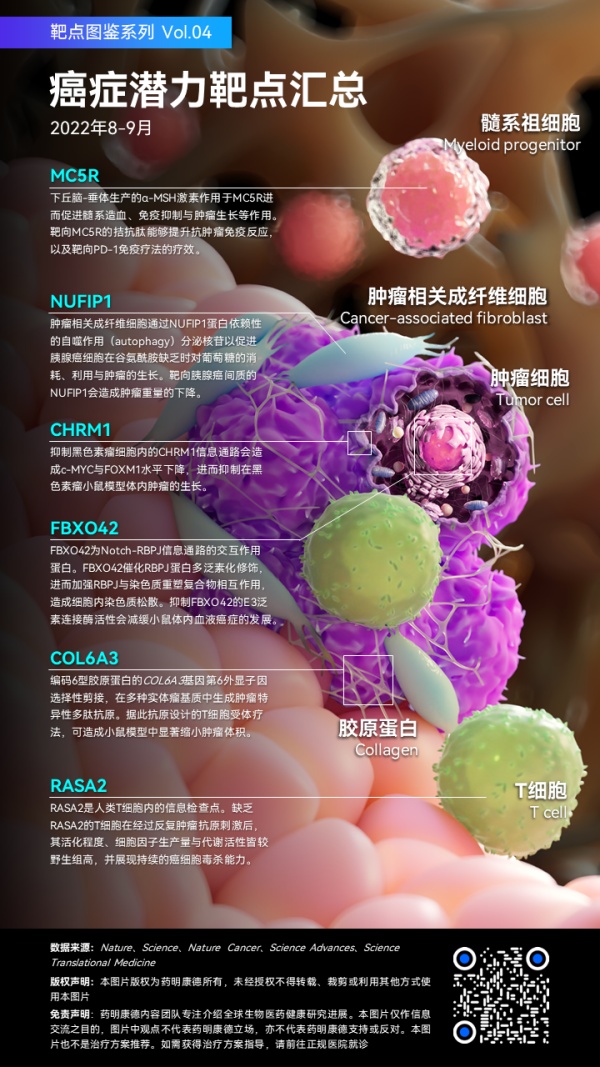
靶点:COL6A3
疾病:不限癌种过继性T细胞疗法靶标
期刊/ PMID: Science Translational Medicine / 36044599
发现:T细胞受体疗法靶向细胞内外抗原,但此抗原肽片段须在肿瘤细胞上,通过与特定人类白细胞抗原(HLA)分子结合,成为peptide-HLA(pHLA)复合体呈现,才能为T细胞所识别。因此识别在肿瘤中高度表达但在健康组织内罕见、具高度TCR亲和力的pHLA复合体为TCR疗法成功的关键之一。通过量化质谱法为基础来分析、比较组织内pHLA复合体的技术,并对约1500个肿瘤与健康组织检体的测试,其中包含了来自11种不同实体瘤病患组织,以及利用人工智能量化分析每个细胞中含有各种pHLA复合体拷贝数后,研究人员发现一种由HLA-A*02:01所呈现的肿瘤特异性肽片段。此片段来自编码6型胶原蛋白的COL6A3基因,其第六外显子(exon 6)因选择性剪接而产生。这种选择性剪接出现在多种实体瘤基质中,但在健康组织内却十分罕见。而根据此所识别出的pHLA复合体所设计出的TCR疗法,在带有人类肿瘤细胞的小鼠当中展现良好疗效。实验结果显示,接受此项TCR疗法小鼠的肿瘤不但生长速度减缓,且有肿瘤缩小的情形。重要的是,此疗法的耐受性良好,研究人员并未观察到此疗法对正常细胞的任何毒性。因此COL6A3选择性剪接具潜力被开发成为治疗不同种类实体瘤的T细胞疗法。
靶点:NUFIP1
疾病:胰腺癌
期刊/ PMID: Nature Cancer / 35982178
发现:肿瘤相关成纤维细胞(CAF)是胰腺癌肿瘤微环境中最显著的成分之一。研究人员发现CAF对胰腺癌细胞在谷氨酰胺(glutamine)缺乏时的存活相当重要。CAF能够通过NUFIP1蛋白依赖性的自噬作用(autophagy)机制而分泌核苷(nucleoside),这些由CAF分泌的核苷能够促进胰腺癌细胞在谷氨酰胺缺乏时对葡萄糖的消耗、利用与肿瘤的生长,而此机制依赖MYC基因的作用。关键的是,当靶向胰腺癌原位小鼠肿瘤间质内的NUFIP1蛋白时,会造成肿瘤重量的下降。此项研究除了显示胰腺癌多元代谢网络对肿瘤生长的重要性外,亦显示NUFIP1为胰腺癌可能的靶标。
靶点:MC5R
疾病:加强癌症免疫疗法
期刊/ PMID: 《科学》/ 35926007
发现:下丘脑-垂体(hypothalamic–pituitary)能够分泌多种激素调控免疫反应,而其中有部分下游的激素或效应分子的水平在癌症病患中有增加的情形。研究人员发现,下丘脑-垂体单位能够促进髓系造血(myelopoiesis)与免疫抑制作用,进而促进肿瘤的生长。皮下肿瘤的植入会引发小鼠下丘脑活化,以及垂体分泌α-黑素细胞刺激素(α-MSH)生产。α-MSH通过作用于髓系祖细胞上的黑素皮质素受体5(MC5R)而促进髓系造血、髓系细胞累积、免疫抑制与肿瘤生长等作用。靶向MC5R的拮抗肽能够提升抗肿瘤免疫反应,以及靶向PD-1免疫疗法的疗效。值得一提的是,研究人员亦发现癌症患者血清中的α-MSH水平上升,并且与患者体内循环的髓系抑制细胞量呈正相关。这些发现显示神经内分泌通路可能参与抑制肿瘤免疫反应,以及MC5R为癌症免疫疗法的潜力靶点。
靶点:FBXO42
疾病:血癌
期刊/ PMID: Science Advances / 36129980
发现:Notch-RBPJ信息通路的失调是造成许多包含癌症在内疾病的原因,然而此关键通路是如何在细胞内被调控、相关蛋白的修饰以及相互作用的蛋白等信息却多为未知。研究人员利用蛋白质组学方法,识别出FBXO42为RBPJ新的交互作用蛋白。FBXO42在RBPJ蛋白Lys-175处催化赖氨酸-63(K-63)连接的多泛素化(polyubiquitination)链形成,进而加强RBPJ与染色质重塑复合物相互作用,造成细胞内染色质松散。重要的是,当基因敲除FBXO42,或是药理学方式抑制FBXO42的E3泛素连接酶活性时,皆减缓在小鼠体内与Notch信息通路相关的血液癌症的发展。因此靶向FBXO42可能是干预Notch信息通路以治疗血癌的潜力靶点。
靶点:CHRM1
疾病:黑色素瘤
期刊/ PMID: Science Advances / 36054350
发现:浅色皮肤者罹患黑色素瘤的风险较深色皮肤者高30倍。科学家研究来自横跨不同深浅肤色人群的原代黑色素细胞,以及临床前黑色素瘤模型后发现,独立于紫外光照射与黑色素(melanin)因素,细胞内在的差异是决定浅色与深色黑色素细胞增殖能力与转化成恶性肿瘤的关键。而此关键便在于深色皮肤的黑色素细胞具有较高水平的黑色素前体二羟基苯丙氨酸(DOPA)。通过高通量药理与活体CRISPR筛选后,科学家发现DOPA能够借由抑制细胞内的毒蕈碱型胆碱受体M1(CHRM1)信号而限制黑色素细胞与黑色素瘤细胞增殖。CHRM1拮抗剂会导致黑色素瘤细胞内的c-MYC与FOXM1水平下降。这两个蛋白是驱动侵袭性黑色素瘤细胞增殖的重要蛋白。临床前黑色素瘤小鼠模型中亦显示,当以小分子抑制CHRM1或FOXM1皆抑制肿瘤生长,因此CHRM1可能为治疗黑色素瘤的新靶标。
希望这些优秀的研究成果可以早日获得临床转化,造福更多受疾病所苦的癌症患者!
来源:药明康德
版权及免责声明:本网站所有文章除标明原创外,均来自网络。登载本文的目的为传播行业信息,内容仅供参考,如有侵权请联系答魔删除。文章版权归原作者及原出处所有。本网拥有对此声明的最终解释权。


{replyUser1} 回复 {replyUser2}:{content}