一周盘点 | 利用“合成致死”的蛋白降解剂、治疗卵巢功能不全的外泌体疗法临床试验在即...
利用“合成致死”的蛋白降解剂、治疗卵巢功能不全的外泌体疗法临床试验在即...
·
·
·
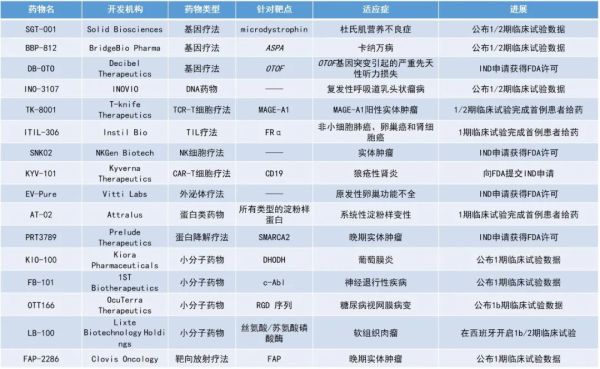
1. 卡纳万病(Canavan)基因疗法BBP-812的1/2期临床试验的初步数据积极。2. 杜氏肌营养不良症基因疗法SGT-001在用药一年后显著改善患者的行走功能。3. 首个用于治疗原发性卵巢功能不全的同种异体外泌体疗法EV-Pure提交IND申请获FDA批准。4. 利用“合成致死”效应的潜在“first-in-class”强效SMARCA2蛋白降解剂PRT3789提交IND申请获FDA批准。BridgeBio Pharma公布了其用于治疗卡纳万病的研究性静脉注射AAV9基因疗法BBP-812的1/2期临床试验数据。BBP-812能够将ASPA基因的功能拷贝递送到全身并进入大脑,从而可能根治疾病。卡纳万病是一种由编码天冬氨酸酶的ASPA基因突变引起的超罕见、可致残或致命的疾病。大多数儿童无法爬行、行走、坐着或说话,在幼时就会面临死亡的威胁。天冬氨酸酶活性的缺乏会导致N-乙酰天冬氨酸(NAA)的积累,并最终导致对髓鞘的毒性。目前,该病尚无获批的疗法。此次所公布3例患者的药效学数据显示,接受BBP-812治疗3-6个月后,患者脑脊液、脑白质及尿液中的NAA持续且大幅度的减少,这表明此在研疗法能够产生功能性的ASPA酶。新闻稿指出,如果临床试验成功,BBP-812将成为出生时患有卡纳万病的儿童的首个治疗选择。此前,BBP-812已被FDA授予快速通道资格、罕见儿科疾病认定和孤儿药资格。BBP-812还被欧洲药品管理局(EMA)授予孤儿药资格。Solid Biosciences公布了其基因疗法SGT-001在1/2期临床试验中的更新的数据。SGT-001能通过新型腺相关病毒(AAV)载体,将合成微抗肌萎缩蛋白(microdystrophin)的转基因递送至患者体内,治疗杜氏肌营养不良症(DMD)的遗传根源。该临床试验结果显示,给药一年后,接受SGT-001治疗患者的行走功能得到了改善。SV95C是一项由可穿戴设备测量的指标,用于评估患者日常生活中最快的自发进行步伐,被EMA认定为五岁及以上DMD患者临床试验中可用的次要终点。在该临床试验中,接受SGT-001的患者的SV95C水平与基线时相比改善了8.8%-9.5%,与疾病自然史数据相比改善了23.9%-24.6%,与对照组患者相比改善了26.0%-26.7%。此前,SGT-001已被FDA授予罕见儿科疾病认定、快速通道资格,并被FDA和EMA授予孤儿药资格。EV-Pure是一种同种异体外泌体疗法,适用于原发性卵巢功能不全的女性。原发性卵巢功能不全导致约1%的40岁以下的女性不孕,这种疾病的并发症还包括早期骨质疏松症、早发性心脏病,以及无法怀孕引起的抑郁症和焦虑症等严重问题,目前尚无获批的疗法。根据新闻稿,该疗法是在该适应症中首个提交IND申请获得FDA批准的同种异体外泌体疗法。PRT3789是一种潜在“first-in-class”的强效选择性SMARCA2蛋白降解剂。SMARCA2和SMARCA4参与多个致癌过程,包括允许DNA转录为RNA的过程。在某些特定的癌症(包括非小细胞肺癌)中,约10%-20%的患者携带SMARCA4突变。由于SMARCA2或SMARCA4的活性是肿瘤细胞生长所必需的,因此具SMARCA4缺陷的癌细胞高度依赖SMARCA2生存。在SMARCA4缺陷的癌症中降解SMARCA2蛋白被认为会产生很强的“合成致死”效应,导致癌细胞死亡,同时不伤害拥有SMARCA4表达的正常细胞。INOVIO公布了DNA疗法INO-3107临床1/2期试验数据。INO-3107用于治疗成人HPV 6和HPV 11相关的复发性呼吸道乳头状瘤病(RRP)。此疗法旨在引发针对HPV 6和HPV 11的靶向T细胞反应,以杀死受感染的细胞,使乳头状瘤消退,并可能清除或降低病毒水平,从而防止或减缓新乳头状瘤生长。此次公布的研究结果显示,与前一年相比,使用INO-3107治疗的21名受试者中,有16名(76%)手术干预次数降低,6名受试者在试验期间无需手术干预,该临床终点的改善具有统计学意义。此外,INO-3107具有良好的耐受性和免疫原性。2020年,FDA授予INO-3107孤儿药资格,用于治疗RRP。Kiora Pharmaceuticals公布了其二氢乳清酸脱氢酶(DHODH)抑制剂KIO-100用于治疗葡萄膜炎的1期试验结果。葡萄膜炎是一种T细胞介导的眼内炎症性疾病。结果显示,玻璃体内注射KIO-100能以剂量依赖性方式减少眼内炎症,并在研究期间显著提高视力。最高剂量组在第14天时在ETDRS视力表字母评估视力方面的改善达三行(相当于分辨率加倍),并保持稳定直到第28天。此外,该药物耐受性良好,对眼内组织没有严重的副作用或其他不良事件。1ST Biotherapyatetics公布了其c-Abl抑制剂FB-101的1期临床数据。FB-101正在被开发用于治疗帕金森病,并可能用于与α-突触核蛋白病相关的其他神经退行性疾病。FB-101的1期临床试验的单剂量递增部分在健康的成人受试者中完成。结果显示,口服FB-101在所有队列中均具有良好的耐受性和安全性。FB-101的血液浓度呈剂量依赖性,未观察到年龄或性别差异。值得注意的是,从受试者身上收集的脑脊液证实了FB-101具有强烈的血脑屏障渗透性。OcuTerra Therapeutics公布了其OTT166眼药水用于治疗糖尿病视网膜病变的1b期临床试验数据。OTT166为一在研选择性小分子RGD序列抑制剂。研究结果显示,OTT166的耐受性良好,没有眼部或全身毒性的证据,没有报告药物相关的严重不良事件,并且患者在整体试验中所展现的最佳矫正视力(BCVA)稳定。在研究结束时,两组的平均和中位视网膜厚度(CRT)都有临床意义的减少(分别为-22/-28微米),37%的患者被认为获得了临床缓解。Clovis Oncology公布了其靶向成纤维细胞活化蛋白(FAP)的放射治疗候选药物FAP-2286在实体肿瘤中的1期临床试验数据。FAP在多种肿瘤类型中表达,是具有前景的癌症治疗靶点。此次公布的数据显示,未观察到与177Lu-FAP-2286相关的严重不良事件、治疗中断或死亡。目前已在1名患者中确认了部分缓解(PR),并在1名患者中确认了疾病稳定(SD)。此外,FAP-2286在一系列实体肿瘤中展现出高肿瘤摄取率,并能长时间留存。DB-OTO是针对由编码otoferlin的OTOF基因突变引起的严重先天性听力损失的基因疗法。正常的otoferlin使耳朵的感觉细胞响应声音刺激而释放神经递质,从而激活听觉神经元。无功能性的otoferlin则无法将听觉信号传递到大脑。DB-OTO使用AAV载体将OTOF基因的健康拷贝传递至耳蜗毛细胞,以此恢复长期的生理听力。2021年,DB-OTO获得了FDA的孤儿药资格和罕见儿科疾病认定。TK-8001是一种TCR-T细胞疗法,对黑色素瘤相关抗原基因A1(MAGE-A1)具有特异性,适用于实体瘤患者。MAGE-A1是侵袭性癌症的标志,与不良的临床预后有关,且有大量证据表明MAGE-A1是肿瘤发生的潜在驱动因素。与使用来自人类供体的TCR-T细胞相比,TK-8001在体外表现出连续杀伤活性,并具有增强的体内抗肿瘤活性。ITIL-306是一种自体肿瘤浸润淋巴细胞(TIL)疗法,采用Instil Bio专有的CoStAR分子设计,该分子被叶酸受体α(FRα)激活,在肿瘤微环境中提供强大的共刺激信号。CoStAR建立在天然TIL的关键优势之上,以增强肿瘤微环境中TIL的细胞因子释放,细胞溶解活性和TIL的增殖。先前发表的临床前数据表明,CoStAR-T细胞能够在没有外源性IL-2的情况下增强体内肿瘤控制,能够支持ITIL-306的1期研究中不含IL-2的治疗方案。KYV-101是一款处于临床阶段、靶向CD19的CAR-T细胞疗法,其特性尤其适用于治疗B细胞驱动的自身免疫性疾病,如狼疮性肾炎、系统性硬化症和炎性肌病。临床前研究证明,该疗法可在疾病模型的血液循环和组织中,诱导深度和完全的B细胞耗竭,产生显著疗效。AT-02是泛淀粉样蛋白去除(PAR)肽技术与IgG1抗体的融合蛋白,正在开发用于治疗系统性淀粉样变性(SA)。AT-02能够以亚摩尔亲和力与ATTR和AL淀粉样蛋白结合,促进巨噬细胞介导的淀粉样蛋白吞噬作用。体内临床前数据显示,在人AL淀粉样瘤和系统性AA淀粉样变性小鼠模型中,淀粉样蛋白显著减少。与未经治疗的动物相比,AT-02治疗患有进行性系统性AA淀粉样变性的小鼠,可将局部心脏淀粉样蛋白减少约50%,并显著减少肾和肝淀粉样蛋白和器官损伤。LB-100是一种抑制丝氨酸/苏氨酸磷酸酶的临床候选药物。丝氨酸/苏氨酸磷酸酶无处不在,并一直被认为是抗癌药物的潜在重要靶点。然而,由于这些酶的多功能性,人们普遍认为抑制这些磷酸酶的药物会产生极大毒性,无法将它们发展为抗癌治疗。但Lixte Biotechnology Holdings的临床前研究表明,LB-100单药可抑制一系列人类癌症,当与标准细胞毒杀药物和/或放射疗法结合使用时,LB-100可增强其对血液学和实体瘤癌症的有效性,且不会增强毒性。此外,在癌症动物模型中以非常低的剂量给药时,LB-100显著提高了PD-1阻断剂的有效性。这项临床试验旨在检视LB-100与阿霉素联合治疗软组织肉瘤的疗效和安全性。

来源:药明康德
版权及免责声明:本网站所有文章除标明原创外,均来自网络。登载本文的目的为传播行业信息,内容仅供参考,如有侵权请联系答魔删除。文章版权归原作者及原出处所有。本网拥有对此声明的最终解释权。






{replyUser1} 回复 {replyUser2}:{content}