百济PD-1转战欧洲,君实、康方谁能拿下FDA首个鼻咽癌适应证?欧洲为何成出海“真香”地?
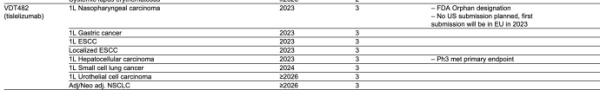
10月25日,诺华发布了2022年三季报,其中披露了其自有管线和合作管线的进展。其中隐约透露了一条信息:百济神州的PD-1替雷利珠单抗治疗鼻咽癌适应证暂无美国上市申请提交计划,并且2023年将会在欧盟首次提交。这也意味着替雷利珠单抗或许已取消今年在FDA的上市计划,但可能是首个在欧盟提交鼻咽癌适应证上市申请的国产PD-1。
 图片来源:诺华2022年三季报
图片来源:诺华2022年三季报
而对于中国创新药行业而言,若国产PD-1产品成功出海欧盟,其批准路径也能够直接反映出欧盟监管机构对PD-1的审评审批标准,以及欧美人群对于PD-1国际多中心临床数据在上市审批中的必要程度。
美国临床试验注册库(ClinicalTrials.gov)显示,目前已经计划在美上市PD-1鼻咽癌适应证的三家国内药企——百济神州、君实生物、康方生物,其依据的临床试验几乎都缺少欧美人种的数据。
如今,百济神州和君实生物的PD-1在FDA的BLA申请(生物制品许可申请)都因不同原因遭到了延期,如果替雷利珠单抗在欧盟顺利获批,或许欧盟将成为国产PD-1出海的另一条通路。
01
都缺失多区域数据?
今年上半年,信达生物披露了FDA未能批准信迪利单抗BLA申请的完整回复:建议信迪例单抗联合化疗与一线转移性NSCLC的标准疗法进行以总生存期为终点、多区域的非劣效性临床试验。也就是说“多区域”或许是出海审评的“硬指标”之一。
但观察目前拥有鼻咽癌适应证的几个国产PD-1的临床试验,几乎都缺失欧美人群的数据。
美国临床试验注册库(ClinicalTrials.gov)显示,百济神州、恒瑞医药和君实生物的一线鼻咽癌适应证的III期临床试验大多以国内或者其他亚洲地区为主。康方生物和正大天晴合作的派安普利单抗在美国递交三线治疗转移性鼻咽癌适应证的上市申请也是基于主要来自国内的临床试验数据。
另一方面,公开数据显示,鼻咽癌在欧美国家罕见,年发病率约1/10万,大多数鼻咽癌发生在中国,这或许是多家公司与鼻咽癌相关的临床试验普遍在中国或亚洲地区开展的原因。
百济神州在2021年年报中披露,替雷利珠单抗报告期内针对鼻咽癌的研究包括联合化疗对比安慰剂联合化疗用于一线治疗鼻咽癌患者的中国与泰国3期临床试验(NCT03924986)。NCT03924986在ClinicalTrials.gov上的登记信息也显示海外研究仅有泰国。
据此前君实生物发布的公告,特瑞普利单抗的BLA申请于今年7月再度获得了FDA的受理,其依据为POLARIS-02研究(NCT02915432)及JUPITER-02研究(NCT03581786)的数据结果。POLARIS-02研究是一项多中心、开放标签、II期关键注册临床研究。JUPITER-02研究是一项随机、双盲、安慰剂对照、国际多中心的III期关键注册临床研究。
但NCT02915432研究的23个研究位置全部位于国内;NCT03581786研究的32个研究位置仅有1个来自新加坡,其余全部在国内。
据悉,特瑞普利单抗是国内首个获批上市的国产PD-1单抗。2021年8月,特瑞普利单抗联合吉西他滨/顺铂作为晚期复发或转移性鼻咽癌患者的一线治疗获得FDA突破性疗法认定。2022年7月,FDA受理了重新提交的特瑞普利单抗联合吉西他滨/顺铂作为晚期复发或转移性鼻咽癌患者的一线治疗和单药用于复发或转移性鼻咽癌含铂治疗后的二线及以上治疗的BLA,处方药用户付费法案(PDUFA)的目标审评日期定为2022年12月23日。
恒瑞医药虽然没有披露卡瑞利珠单抗治疗鼻咽癌是否有海外上市规划,但该适应证的III期临床研究NCT03707509研究在ClinicalTrials.gov上的登记信息全部为国内研究,并无海外临床记录。
但并非没有国产PD-1在美国进行临床试验。ClinicalTrials.gov显示,派安普利单抗治疗一线鼻咽癌的III期临床中41个研究位置有3个位于美国。
02
欧盟或将为百济PD-1主要阵地?
如果按照目前百济神州在欧洲推进替雷利珠单抗上市申请的进程来看,欧洲或许将是替雷利珠单抗出海的“第一站”。
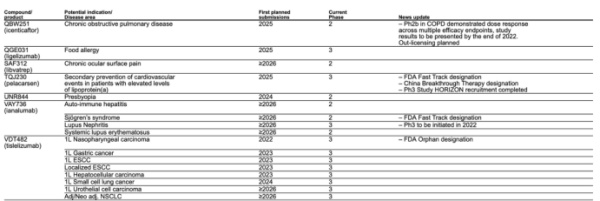
百济神州于8月30日发布的2022年中报显示,在欧洲,替雷利珠单抗用于治疗非小细胞肺癌(NSCLC)以及二线治疗食管鳞状细胞癌(ESCC)的上市许可申请(MAA)已获得欧洲药品管理局(EMA)受理,目前正在审评中;替雷利珠单抗用于治疗一线、二线NSCLC和二线ESCC的新药上市申请已获澳大利亚药品监督管理局(TGA)受理;在与诺华的合作下,英国药品与保健品管理局(MHRA)已受理替雷利珠单抗在英国用于治疗一线、二线NSCLC和二线ESCC的新药上市申请。
在美国,FDA延期了替雷利珠单抗针对既往全身治疗后不可切除的复发性局部晚期或转移性ESCC的BLA审批时间,但百济神州将继续支持诺华计划于2023年在美国递交的替雷利珠单抗用于一线治疗胃癌、一线和局部治疗ESCC和一线治疗肝细胞癌(HCC)的药政申报工作。
值得注意的是,诺华曾在半年报中披露,2022年内将计划首次向FDA提交替雷利珠单抗一线鼻咽癌上市申请。
 图片来源:诺华2022年中报
图片来源:诺华2022年中报
但百济神州在其半年报中表示,2022年内暂无在美国递交用于其它适应证的上市申请计划。
此外,在FDA延期百济神州的食管鳞癌BLA审批的同时,诺华决定暂不推进原定于今年下半年在美国递交替雷利珠单抗用于二线治疗非小细胞肺癌的上市许可申请的计划。据外媒ENDPOINTS NEWS报道,在第二季度电话会议上,诺华首席执行官Vas Narasimhan透露,FDA认为百济神州主导的临床研究在患者数量和使用的标准治疗方面没有充分反映美国人群特征。
那么欧洲和澳大利亚是否将成为百济神州PD-1出海的下一站呢?
在此前百济神州披露的公告显示,在欧盟申报的替雷利珠单抗NSCLC适应证主要包括:

图片来源:百济神州2022年中报
主要基于3项临床试验(NCT03358875、NCT03594747、NCT03663205)的结果。这3项试验共纳入了1499例患者,其中包括一项随机、开放性、全球 3 期临床试验RATIONALE 303(NCT03358875)。该试验旨在对比百泽安®和多西他赛用于针对既往经含铂化疗后出现疾病进展的二线或三线局部晚期或转移性NSCLC患者。该试验在美洲、欧洲、亚洲和大洋洲的10个国家共入组了805 例患者,患者以2:1的比例随机分配至替雷利珠单抗组或多西他赛组。
而ESCC的新适应证上市许可申请是基于一项随机、开放性、多中心的全球 3 期试验 RATIONALE 302(NCT03430843)的结果,ClinicalTrials.gov网站显示,NCT03430843的研究位置包括美国、比利时、中国、法国、德国、意大利、日本、韩国、西班牙和英国。
此外,在商业化和后续研发方面,前有泽布替尼铺路,百济神州在瑞士巴塞尔正式启用新的地区办事处,并且已在欧洲建立起商业化和临床开发团队,巴塞尔办事处也将作为其在欧洲的区域运营中心。
03
欧洲是出海的好选择吗?
美国作为全球最大医药市场,成为中国药企出海首选市场无可厚非。不过市场规模仅次于美国、同样具有发展成熟、体量庞大、增长稳定等特点的欧洲市场,却往往被低估。2021年全球创新药销售额数据显示,欧洲五国(英国、德国、法国、西班牙、意大利)占有16%的市场份额,位居全球第二。
其实,欧洲市场对新型生物技术的接受程度较美国而言,似乎更高。德勤数据显示,自2015年至2020年,新兴生物技术公司推出的新产品在欧洲药品管理局(EMA)一直占据主导地位,平均每年占EMA批准药物总数的33%,其中新兴生物技术公司推出的产品以孤儿药为主。
从政策支持方面来看,EMA对能够提供潜在临床获益的药物,会授予优先药物(PRIME)资格,通过该计划,EMA主动向药物开发商在早期提供支持,优化生成有关药物益处和风险的强有力数据,在提交上市申请时与企业确认获得加速审评的可能性。通过早期与药物开发人员合作,PRIME支持改进临床试验计划,以便生成的数据适合评估新药应用。
从疾病领域来看,肿瘤是EMA获批的主要治疗领域,其次是血液学、代谢和神经学。
从获批时间来看,欧洲上市时间平均与美国相差半年至一年,其中德国、英国药品上市仅比美国晚约半年,西班牙、法国、意大利比美国晚约一年。显著领先于全球其他国家和地区。
不过阻碍药企“闯”入欧洲的原因或许与欧洲医药市场复杂的环境有关。每个国家具有不同的药品注册与医保支付体系,单一战略可能无法解决不同市场各自的挑战。对于缺乏欧洲市场经验的大多数中国公司而言,应付不同监管当局和支付方的要求,巨大的挑战不言自明。在复杂的市场中运营,企业需要投入大量精力与资金。
从全球领先的Biotech公司的国际化经验来看,在美国、欧洲等全球发达市场中,具有高创新度的产品可通过多种方式自主搭建商业化能力,规模小或竞争激烈的市场则可以考虑商业授权合作。
根据BCG《创新药出海模式各显神通》,2020-2021年,来自美国的新兴Biotech企业在欧洲上市的新药中,有63%的公司属于“亲力亲为”型的自主进行临床+自建商业化团队,这其中包括Seagen、Emergent Biosolutions、Ikena Oncology Insmed、AGC Biologics等。选择通过这种模式拓展欧洲市场的公司,上市产品均为孤儿药或FIC,自身竞争力较强。同时,亲力亲为型拓展对公司自身实力或背靠集团要求也较高,如Seagen的市值达到230亿美元,往往拥有雄厚资金支撑的公司能够实现自主出海。
第二种模式是自主进行国际临床+授权商业化,在欧洲上市的新产品中,有25%选择了这种合作方式,如Opko Health与Vifor Pharma;La Jolla 与Paion。这类合作模式普遍表现为,上市产品的市场竞争力并不十分突出,需要当地领先药企支持商业化拓展,且公司市值在10-20亿美元之间。
另有13%的药企会选择完全授权的模式,将国际临床与商业化均授予国际大药企或当地药企。如Ligand Pharma授权给默沙东的产品为15价肺炎疫苗,对产品的商业化及监管要求较高,因此需要借助国际大药企的能力打通海外渠道。
对中国创新药企而言,应根据自身产品特点、能力基础和目标市场选择合适的出海模式。业内普遍认为,当前阶段下,国内药企做“甩手掌柜”完全授权临床开发和商业化仍是合作出海的主流方式之一。尤其是对非BIC/FIC的产品,国内创新药企在资金、经验或能力尚浅的情况下,采用完全授权仍是一种有效降低风险、快速回笼资金的方式。
另外,自主开展海外临床试验是当前国内创新药企大多会选择的方式之一。自主开展国际多中心临床试验已成为越来越多国产创新药“出海”过程中的关键环节,但BCG报告指出,这种模式要求药企必须打造过硬的临床开发和注册能力,才能在速度与成功率上胜出。但是对很多创新药企业而言,开展全球试验,特别是全球性III期临床试验的挑战依然是巨大的。
总的来说,创新药出海的目的地不论是美国、欧洲还是全球其他市场,目的都是为全球各地的患者带来创新、差异化的治疗方案。创新药出海与国际化已经成为中国医药创新的重要关键词之一,对正在携产品出海或准备出海的药企来说,差异化的产品、扎实的临床/注册能力、适合的商业化模式、和国际化人才储备是成功出海的制胜因素。
来源:E药经理人
版权及免责声明:本网站所有文章除标明原创外,均来自网络。登载本文的目的为传播行业信息,内容仅供参考,如有侵权请联系答魔删除。文章版权归原作者及原出处所有。本网拥有对此声明的最终解释权。


{replyUser1} 回复 {replyUser2}:{content}